
下列图示与对应的叙述相符的是( )
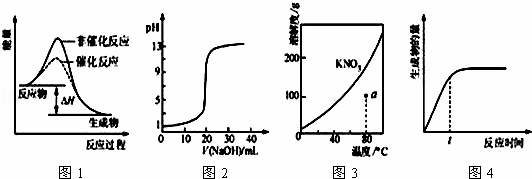
|
| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
|
| B. | 图2表示0.1000 mol•L﹣1NaOH溶液滴定20.00mL0.1000 mol•L﹣1CH3COOH溶液所得到的滴定曲线 |
|
| C. | 图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
|
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v逆>v正 |
考点:
反应热和焓变;溶解度、饱和溶液的概念;物质的量或浓度随时间的变化曲线;中和滴定.
专题:
图示题.
分析:
A.当反应物的能量高于生成物的能量时,反应是放热反应,催化剂是通过降低反应的活化能来加快化学反应速率的;
B.强碱滴定醋酸溶液时,醋酸是弱酸不能完全电离;
C.硝酸钾的溶解度随着温度的升高而增大;
D.t时化学反应没有达到平衡状态,生成物的量不断增多.
解答:
解:A.催化剂是通过降低反应的活化能来加快化学反应速率的,加入催化剂后活化能会降低,但是图中信息得出:反应物的能量高于生成物的能量,反应是放热反应,故A错误;
B.强碱强氧化钠滴定醋酸溶液时,开始20.00mL0.1000mol•L﹣1CH3COOH溶液pH大于1,故B错误;
C.硝酸钾的溶解度随着温度的升高而增大,溶解度曲线下方的点是不饱和溶液的点,故C正确;
D.t时化学反应没有达到平衡状态,生成物的量不断增多,说明反应继续向正反应方向移动,v逆<v正,故D错误.
故选C.
点评:
本题考查较为综合,为高考常见题型,侧重于学生的分析能力的考查,正确分析图象是解决问题的关键,综合性较强,难度较大.


科目:高中化学 来源: 题型:
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )

A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是( )
A. 溶液中溶质质量增加,溶剂量减少,溶液的溶质质量分数变大
B. 溶液的pH不变,有氢气放出
C. 溶液中的Na+数目减小,有氧气放出
D. 溶液中的c(Na+)增大,有氧气放出
查看答案和解析>>
科目:高中化学 来源: 题型:
垃圾分类有利于资源回收利用.下列垃圾归类不合理的是
| A | B | C | D | |
| 垃圾分类 | 废易拉罐 | 不可再生废纸 | 废电池 | 废塑料瓶 |
|
可回收物 |
可燃垃圾 |
有害垃圾 |
其它垃圾 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到.下列说法不正确的是( )
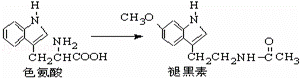
|
| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 |
|
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
|
| C. | 在一定条件下,色氨酸可发生缩聚反应 |
|
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法正确的是
A.Si常用做信息高速公路的骨架—— 光导纤维的主要材料
B.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
C.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验能达到预期目的的是
A.用量筒量取20.00 mL NaOH 溶液
B.向NaOH溶液中加入少量某卤代烃,加热使其充分反应,再滴加几滴硝酸银溶液,观察沉淀的颜色,以此检验该有机物中含有何种卤族元素
C.将碱式滴定管的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可排除尖嘴部分的气泡
D.将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,观察是否有红色沉淀生成,若无则证明该有机物中不含醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B.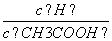 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.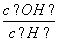
⑵体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________________________________________,
(3)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
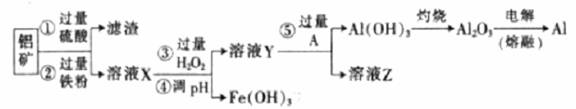
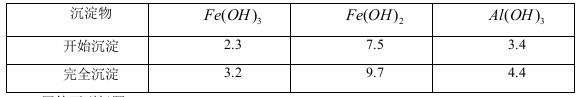
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧Al(OH)3时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:

请写出该电池正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com