
海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。下列装置的模型,能体现海水电池工作原理的是
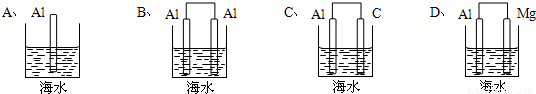
A. A B. B C. C D. D
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
10mL浓度为1mol•L﹣1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是
A. K2SO4 B. CH3COONa C. CuSO4 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高一上学期期末考试化学试卷(解析版) 题型:选择题
将Cl2通入200mL0.5mol·L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1︰2,则通入的Cl2在标准状况下的体积为
A. 0.56L B. 1.68L C. 2.24L D. 1.12L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高一上学期期末考试化学试卷(解析版) 题型:选择题
环境问题越来越受到人们的关注,造成环境问题的主要原因大多是由于人类生产活动中过度排放或对自然界物产过度开采引起的。对于下列环境问题的治理不正确的是
A. 温室效应——减少化石燃料使用,开发清洁能源
B. 雾霾——适当限号,减少汽车尾气排放及扬尘
C. 白色污染——杜绝生产塑料袋,从根源上治理
D. 水体污染——节约用水,减少污水排放
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:选择题
下列四支试管中,过氧化氢分解的化学反应速率最大的是
试管 | 温度 | 过氧化氢溶液的浓度 | 催化剂 |
A | 室温(25℃) | 12% | 有 |
B | 水浴加热(50℃) | 8% | 有 |
C | 水浴加热(50℃) | 12% | 有 |
D | 室温(25℃) | 8% | 无 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:选择题
分类法是研究化学物质及其变化的一种常用的科学方法,下列分类不正确的是
A. 糖类、油脂、蛋白质均属于营养物质
B. 甲烷、乙醇、葡萄糖均属于有机物
C. NaOH与H2SO4均属于电解质
D. 纯碱、烧碱均属于碱
查看答案和解析>>
科目:高中化学 来源:2017届山西省名校高三下学期联考理综化学试卷(解析版) 题型:简答题
人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________。
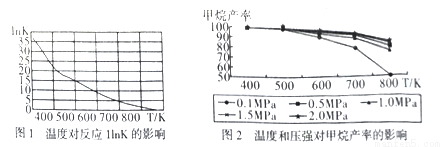
②提高甲烷反应选择性的关键因素是_______,根据相关知识和图2分析合成甲烷适宜的反应条件是
在550~630K,1MPa的原因是__________________。
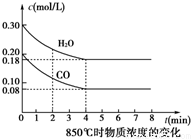
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________。
查看答案和解析>>
科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:选择题
已知还原性:SO32->I-。某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如下实验:
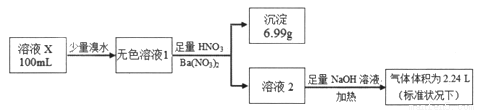
下列说法正确的是
A. 溶液X肯定只存在NH4+、SO42-
B. 溶液X一定不含有Ba2+、Fe3+,可能含有I-
C. 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液
D. 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数,下列说法正确的是
A. 24g金属镁变为镁离子时失去的电子数为NA
B. 18g水所含的电子数目为NA
C. 在常温常压下11.2L二氧化硫所含的分子数目为0.5NA
D. 在常温常压下32g氧气所含的原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com