
一、实验用品:纯锌片,铜片,37%的浓盐酸,蒸馏水,氯化铜溶液。
二、实验记录:
交流卡片 NO:2006—SY—518 主题:Zn,Cu与浓盐酸 A.将锌放入浓盐酸中,反应较快 B.将锌片与铜片贴在一起,一同投入浓盐酸中,反应快速放出气体 C.当B中锌片完全溶解后,将溶液加热,又产生气体(值得进一步探究),得到无色溶液 D.将上述反应后的溶液,隔绝空气,加入适量水,出现白色沉淀 |
三、提供资料:
资料卡片 NO:2006—ZL—918 主题:生成一价铜的反应 ①课本上:CH3CHO+2Cu(OH)2 ②盐城市第二次调研试卷:Cu2++4I-====2CuI(白色)↓+I2 ③《无机化学》下册,p788,氯化亚铜在不同浓度的KCl溶液中可形成[CuCl2]-、[CuCl3]2-、[CuCl4]3-等离子,且它们在溶液中均为无色。 |
四、请你参与以下探究:
(1)交流卡片中,实验A反应速率明显比B小,原因是:___________________________。
(2)根据铜位于金属活动顺序表氢之后,与稀盐酸不反应,依据交流卡片C又产生气体的事实。作出如下推断:
①有同学认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是:__________________。
②某同学作了如下猜想,是否成立,请你设计实验方案加以验证:
猜想 | 验证方法 | 预测现象及结论 |
认为铜片中可能含有锌等杂质 |
|
|
(3)交流卡片D中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会产生出沉淀。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个,只设计两个方案):
| 预设验证方法 | 预测的现象与结论 |
白色沉淀是氯化亚铜 |
|
|
|
|
(4)指导老师肯定了白色沉淀是氯化亚铜,请结合资料卡片③,写出铜与足量盐酸在加热条件下反应生成无色溶液及气体的化学方程式:___________________。根据交流卡片D,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系式:___________________(用离子方程式表示)。
(5)就铜与浓盐酸反应若还需进一步探讨,你认为还可探究的内容有:___________________(只提供一个实验课题即可)。
(1)铜、锌及浓盐酸一起组成了原电池,加快了反应速率
(2)①没有道理,因为氢气本身难溶于水②?
将铜片加入稀硫酸中,并微热 | 若无气体放出,则不含锌等活泼金属杂质;若有气体,则有锌等杂质 |
(3)(4分)
| 预设验证方法 | 预测的现象与结论 |
白色沉淀是氯化亚铜 | 白色沉淀加入稀盐酸中,通入氧气(或稀HNO3等强氧化剂) | 溶液变蓝色,说明是一价铜 |
向氯化亚铜悬浊液中加入氯化钾浓溶液 | 若白色沉淀消失且得无色溶液,则原白色沉淀为氯化亚铜,否则不是 |
(4)2Cu+8HCl====2H3[CuCl4]+H2↑〔或2Cu+4HCl====2H[CuCl2]+H2↑;
2Cu+6HCl====2H2[CuCl3]+H2↑〕
[CuCl4]3-(aq)![]() CuCl(s)+3Cl-(aq)〔(或[CuCl2]-(aq)+2Cl-)
CuCl(s)+3Cl-(aq)〔(或[CuCl2]-(aq)+2Cl-)
[CuCl3]2-(aq) ![]() CuCl(s)+2Cl-(aq)
CuCl(s)+2Cl-(aq)
(5)用变量控制法探讨铜与盐酸发生反应生成氢气和白色沉淀;盐酸的适宜浓度(其他合理答案均可)


科目:高中化学 来源: 题型:
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省、庄河高中高三上学期期末联考卷三化学试卷 题型:实验题
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气 体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
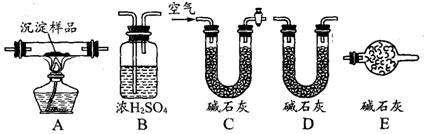
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com