
科目:高中化学 来源:2017届湖北省高三上学期11月月考化学试卷(解析版) 题型:推断题
如图①﹣⑩分别代表有关反应中的一种物质,请填写以下空白.

(1)已知①中阴阳离子个数比为1:1,则①的化学式是_________,②的电子式为_________;
(2)图中涉及的氧化还原反应共有_________个
(3)③与④反应的化学方程式为:_______________。
(4)⑧与⑨反应的化学方程式为:_______________。
(5)一定条件下,将2amL④和⑦的混合气体用排水法收集,得amL气体,则原混合气体中④和⑦的体积比为 。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是
A. NH4Cl固体中混有少量的I2,可用加热的方法将I2除去
B. 少量浓硝酸保存在无色细口瓶中
C. 用浓硫酸吸收二氧化硫中混有少量SO3气体
D. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自右向左移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
某烯烃与氢气加成后得到饱和烃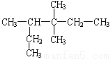 ,则该烯烃可能结构的种数
,则该烯烃可能结构的种数
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁器件上附有铜配件,在接触处易生铁锈 D.银制奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁葫芦岛高级中学高二上期中化学卷(解析版) 题型:选择题
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖,颁奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是

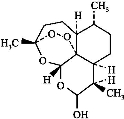
青蒿素 双氢青蒿 素
素
A.青蒿素和双氢青蒿素互为同分异构体
B.由青蒿素制备双氢青蒿素的反应属还原反应
C.青蒿素的分子式为C15H22O5
D.青蒿素分子中含有过氧键和酯基、醚键
查看答案和解析>>
科目:高中化学 来源:2017届湖南省岳阳市华容县四校高三联考二化学试卷(解析版) 题型:实验题
SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称: 。
(2)SnCl2用盐酸而不用水溶解的原因是: 。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: 。
(4)反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
(5)实验室中“漂洗”沉淀的实验操作方法是
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:实验题
某实验小组同学模拟工业制碘的方法,探究ClO 和I
和I 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:

经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。

其中试剂X可以是 (填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L?1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L?1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com