
��0.2 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ���û����Һ��c(Na��)>c(A-)����
��1�������Һ��c(A��)________c(HA)(�>����<����������ͬ)��
��2�������Һ��c(HA)��c(A��)________0.1 mol��L��1��
��3�������Һ�У���ˮ�������c(OH��)________0.2 mol��L��1 HA��Һ����ˮ�������c(H��)��
��4��25 ��ʱ�����ȡ0.2 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ���û����Һ��pH<7����HA�ĵ���̶�________NaA��ˮ��̶ȡ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŰ�����һ�и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������������ᣬ��ʹ���е�����Ũ�ȼ�С����
A��Na+ B��H+ C��CO32- D��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
2NH3(g)+CO2(g)  CO (NH2)2(s)+H2O(g) �ڸÿ��淴Ӧ�У�����ѧƽ�������ƶ�ʱ����ϵ�����ƽ����������
CO (NH2)2(s)+H2O(g) �ڸÿ��淴Ӧ�У�����ѧƽ�������ƶ�ʱ����ϵ�����ƽ����������
A����ȷ�� B����С C������ D�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʦ������ѧ�߶��϶��νβ⻯ѧ���������棩 ���ͣ�ѡ����
����˵������ȷ����
A��ԭ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ��
B��ԭ����е���������һ���Ǹ���������������Ӧ
C��ԭ��ص����������ķ�Ӧ��Ϊ������ԭ��Ӧ
D���γ�ԭ��غ�ԭ����е��������������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�ϵڶ��ζο���ѧ�Ծ��������棩 ���ͣ��ƶ���
��ҵ��������(��Ҫ�ɷ���Al2O3������������Fe2O3��SiO2)��ȡұ������ԭ����������������������ͼ��

��1������ٷ�Ӧ�����ӷ���ʽ��_____________��_______��
��2����Һ1��Ҫ�����Թ���ԭ��B��ԭ��B�Ļ�ѧʽ��_______________������٢ڢ۾�����е�ʵ�������__________(���������)��
��3������������ɳ����Ļ�ѧ����ʽ��_______________��
��4�����ʡȥ����٣����ܽ��������ǴӼ���ԭ��B��ʼ����������������ȡ��ʲôӰ�죿_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŰ�����һ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��25 ��ʱ��ijϡ��Һ����ˮ���������H��Ũ��Ϊ1.0��10��13 mol��L��1�������йظ���Һ��������ȷ����
A������Һһ���ʼ���
B������Һ���ܳ�����
C������Һ��pHһ����1
D������Һ��pH������Ϊ13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹŰ�����һ�и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ΪVL���ܶ�Ϊ��g / cm3��ij��Һ�У�����Ħ������ΪM�����ʵ�������m��������Һ�����ʵ����ʵ���Ũ��Ϊc�����ʵ���������Ϊw�������и���ʾʽ�У���ȷ����
A. 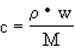 B.
B. 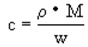 C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������Һ�У��ܴ��������������
A��Mg2+��Fe3+��NO3-��SCN- B��Al3+��Fe2+��Cl-��SO42-
C��K+��Na+��Cl-��HCO3- D��Na+��Ba2+��NO3-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ����ĩ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����е������Һ������ȷ����
A��25 ��ʱ��1 mL pH��1��������100 mL ��ˮ��Һ��Ϻ���Һ��pH��7����ˮ��Һ��pH��11
B����0.2 mol��L-1������0.1 mol��L-1��KAlO2��Һ�������ϣ���Һ������Ũ����С�����˳��
c(OH-)��c(H+)��c(Al3+)��c(K+)��c(Cl-)
C��pH��ȵĢ� NH4Cl ��(NH4)2SO4 ��NH4HSO4��Һ��c(NH4��)��С˳��Ϊ�ڣ��٣���
D��0.1mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�
c(Na��)+c(H��) = c(HCO3��)+c(CO32��)+c(OH��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com