
根据图中包含的信息分析,下列叙述正确的是(  )
)

A.氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量
B.436kJ/mol是指断开1molH 2 中的H-H键需要放出436kJ的能量
C.431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量
D.氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
1g N2中含有x个原子,则阿伏加德罗常数是
A.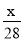 mol-1 B.14x mol-1 C.
mol-1 B.14x mol-1 C.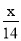 mol-1 D.28x mol-1
mol-1 D.28x mol-1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的4种短周期元素.X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,X、Y、Z、W原子的最外层电子数之和为18.下列说法不正确的是
A. X单质在一定条件下能与Z的最高价氧化物发生置换反应
B. 原子半径:Y>Z>W
C. 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W
D. 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH
D.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
下列关于合金的说法正确的是
①合金至少含两种金属
②合金中元素以化合物形式存在
③合金的熔点比组成成分低
④合金一定是混合物
⑤铁锈是一种铁合金
A.①② B.②③⑤ C.③④ D.③
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
某有机化合物的结构简式如图所示,下列说法正确的是( )

A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g) S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO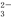 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO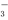 )>c(H+)>c(SO
)>c(H+)>c(SO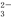 )
)
(3)电化学处理法
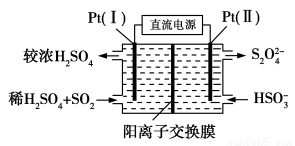
①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:实验题
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示 剂)。请回答下列问题:
剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行 实验,数据记录如下:
实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1mol·L-l Na2CO3溶液中的Na+数目为2NA
B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA
D. 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com