
| A、a=2b |
| B、2a=b |
| C、n=0.48 |
| D、b=0.02 |
| 2.56g |
| 32g/mol |
| 2.56g |
| 32g/mol |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、500 mL 1 mol/L的KNO3溶液 |
| B、500 mL 1 mol/L的Ba(NO3)2溶液 |
| C、100 mL 0.5 mol/L的Mg(NO3)2溶液 |
| D、1 L 0.5 mol/L的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原剂只有锂 |
| B、SOCl2中既有离子键,也有共价键 |
| C、氧化产物包括LiCl和SO2 |
| D、标准状况下生成1.12LSO2时,反应转移电子为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
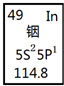
| A、铟元素的质量数是114.8 |
| B、铟元素的相对原子质量是115,中子数为66 |
| C、铟元素是一种主族元素,位于第五周期第ⅢA族 |
| D、铟原子最外层有3个能量相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、504mL |
| B、336mL |
| C、224mL |
| D、168mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,当有3NA个电子转移时,△H变为-46.2kJ?mol-1 |
| B、1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C、2.9g熟石膏(2CaSO4?H2O)含有的结晶水分子数为0.01NA个 |
| D、由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com