
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.H2O与BeCl2为V形 B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形 D.SO3与CO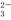 为平面三角形
为平面三角形
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列有关能源的说法不正确的是
A.煤、石油、天然气、氢能中,其中氢能是可再生能源
B.生物质能包括农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等
C.贮氢合金的发现和应用,解决了氢气贮存、运输的难题
D.生物质能通过直接燃烧产生热量 ,能量利用效率较高
,能量利用效率较高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.95 ℃纯水的 pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至 10 倍后 pH=4
C.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7
D.pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:填空题
化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。
(2)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应H2(g)+Cl2(g)=2HCl(g)的△H= 。
(3)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
(4)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为 ;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
已知:(1)Zn(s)+1/2O2(g)=ZnO(s) ΔH=-350kJ/mol,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) ΔH=-25kJ/mol,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的ΔH等于
A.-375 kJ/mol B.-325 kJ/mol
C.+375 kJ/mol D.+325 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.熔融状态能导电
C.水溶液能导电 D.具有较高的熔点
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.20 | a |
④ | 800 | 0.10 | 0.10 | b |
下列说法正确的是 ( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为50%
D.实验④中,达到平衡时,b<0.05
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2= (用K1、K3表示)。
(2)反应Ⅲ自发进行条件是 (填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T 500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= 。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com