
 “水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:安徽省宿州市2012届高三第一次教学质量检测化学试题 题型:022
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.
(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有________特性,使之能与钠离子充分接触.
(2)“水”电池总反应可表示为:5MnO2+2Ag+2NaCl![]() Na2Mn5O10+2AgCl,该电池的负极反应式为________.
Na2Mn5O10+2AgCl,该电池的负极反应式为________.
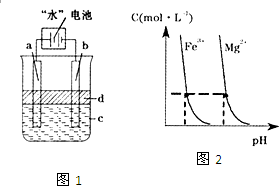
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如下图所示,已知两电极的材料分别为石墨和铁.
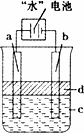
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的________制成(填编号,下同).
A.MnO2
B.Ag
C.NaCl
D.Na2Mn5O10
E.AgCl
②a极的电极反应式为________.
③电解液c可以是________.
A.纯水
B.NaCl溶液
C.H2SO4溶液
D.CuCl2溶液
④当生成1 mol Fe(OH)2白色沉淀时将消耗MnO2________mol.
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如下图.请据图分析:
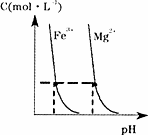
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]________KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省宿州市高三第一次教学质量检测化学试卷 题型:填空题
(16分)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池。
(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有 特性,使之能与钠离子充分接触。
(2)“水”电池总反应可表示为: 该电池的负极反应式为 。
该电池的负极反应式为 。
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如右下图所示,已知两电极的材料分别为石墨和铁。
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的 制成(填编号,下同)。

A.MnO2 B.Ag C.NaCl D.Na2Mn5O10 E.AgCl
②a极的电极反应式为 。
③电解液c可以是 。
A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2 mol。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中
达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关
系如右图。请据图分析:
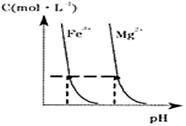
① 温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池。
(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有 特性,使之能与钠离子充分接触。
(2)“水”电池总反应可表示为:该电池的负极反应式为 。
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如右下图所示,已知两电极的材料分别为石墨和铁。
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的 制成(填编号,下同)。
A.MnO2 B.Ag C.NaCl D.Na2Mn5O10 E.AgCl
②a极的电极反应式为 。
③电解液c可以是 。
A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2 mol。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中
达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关
系如右图。请据图分析:
① 温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省宿州市高三第一次教学质量检测化学试卷 题型:填空题
(16分)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池。
(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有 特性,使之能与钠离子充分接触。
(2)“水”电池总反应可表示为: 该电池的负极反应式为 。
该电池的负极反应式为 。
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如右下图所示,已知两电极的材料分别为石墨和铁。
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的 制成(填编号,下同)。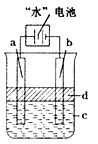
A.MnO2 B.Ag C.NaCl D.Na2Mn5O10 E.AgCl
②a极的电极反应式为 。
③电解液c可以是 。
A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2 mol。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中
达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关
系如右图。请据图分析: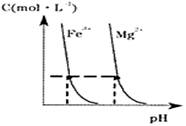
① 温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com