
【题目】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
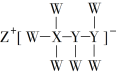
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
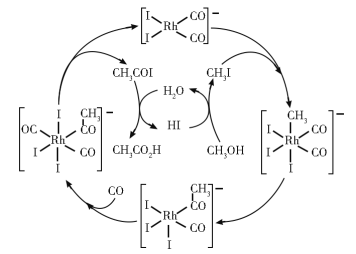
下列叙述错误的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO=CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI=CH3I+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=98 kJ·mol1。回答下列问题:
SO3(g) ΔH=98 kJ·mol1。回答下列问题:
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。

(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。

(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() 1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。

曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
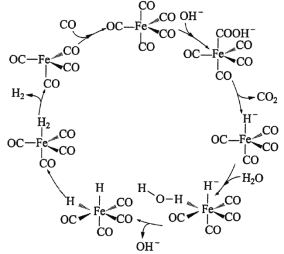
A.OH-参与了该催化循环B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组,在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O(可能产物)等也具有强氧化性,氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是_________,验证乙同学的推测是否正确的方法是_________,当出现_________现象时,即说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学方案中是否含有出O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
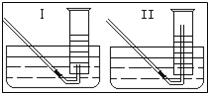
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的_______,理由是________。
②若在标准状况下测量气体的体积,应选用量筒的大小规格为______(选填“l00mL”、“200mL”、“500mL”或“l000mL”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学发布了三份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液(1)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cu2+ | 0.2 |
Ba2+ | 0.5 | NO3- | 1.5 |
Mg2+ | 0.3 | Cl- | 0.6 |
溶液(2)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.9 |
Ag+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 |
溶液(3)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.2 |
K+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 | SO42- | 0.4 |
试分析判断:上述三份检测结果是否可靠,若不可靠,说出理由。
I.溶液(1)结果是否可靠________,理由________。
溶液(2)结果是否可靠_________,理由________。
溶液(3)结果是否可靠_________,理由________。
II.乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-,SO42-,NH4+,CO32-,K+,Na+;
已知:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(假定气体全部逸出 )
(1)溶液中一定存在的离子有_____,可能存在的离子有_____。
(2)原溶液中![]() ___
___![]() ,
,![]() ___
___![]() (填“>”“<”“=”,下同)
(填“>”“<”“=”,下同)
(3)如果上述6种离子都存在,则![]() ____
____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年1月《自然》杂志报道了中科大的研究人员利用直接电解将二氧化碳高效、清洁地转化成液体甲酸燃料的最新成果。下列有关说法不正确的是( )
A.甲酸又称蚁酸,自然界中蚂蚁等昆虫可以分泌甲酸
B.甲酸和油酸含有的官能团相同
C.CO2转变为HCOOH发生还原反应
D.甲酸能发生酯化反应,也能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com