
(1)������һ�������¿�������������
A�� ̼�����ӣ�CH3+ �� B��̼�����ӣ�CH3����C�� �� ����CH3�� D��̼ϩ ����CH2��
���������У�����Ϊ120�����_____������ţ���
��̼�����ӣ�CH3�����Ŀռ乹��Ϊ______����CH3����Ϊ�ȵ������һ�ַ�����__���ѧʽ��
(2)����ȡ�ϳɰ�ԭ�����Ĺ����У�������һЩ���ʣ���CO��ʹ�����ж�����ȥCO�Ļ�ѧ����ʽΪ��HAc��ʾ���ᣩ��Cu��NH3��2Ac+CO+NH3=Cu��NH3��3��CO��Ac����ش��������⣺
�ٸ÷�Ӧ�к��еĵڶ����ڷǽ���Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_________��
��д����̬Cu2+�ļ۵����Ų�ʽ_____________��
�ۻ�����Cu��NH3��3��CO��Ac�У�����Ԫ�صĻ��ϼ�Ϊ___________��
����һ��������NH3��CO2�ܺϳ�����CO��NH2��2��������Cԭ�ӹ�����ӻ�����Ϊ__��1mol���ط����У��� ������ĿΪ______________��
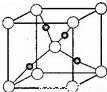
��Cu��OԪ���γɵ�ij�ֻ�����ľ����ṹ��ͼ��ʾ��������٤������ΪNA�������ı߳�Ϊa pm������Ԫ�ض�Ӧ�������ڸþ����е�������_____���þ�����ܶ�Ϊ__g•cm��3��
 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ��һ��ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ������
���к�������NaCl�� Na2SO4��Na2CO3�����ʵ�NaNO3��Һ��ѡ���ʵ����Լ���ȥ���ʣ��õ�������NaNO3���壬ʵ����������ͼ��ʾ��

��1������A����Ҫ�ɷ���_____________��______________���ѧʽ����
��2���٢ڢ��о����еķ��������_______________��
��3����Һ3�����������Եõ�NaNO3���壬��Һ3�п϶����е�������__________��Ϊ�˳�ȥ���ʣ�������Һ3�м���������______________��
��4��ʵ��̽��С����ʵ������Ҫ�õ�456 mL1 mol•L-1��HNO3��Һ��������ʵ������ֻ����һƿ8 mol•L-1��HNO3��Һ����С����8mol•L-1��HNO3��Һ����������Һ��
��ʵ��������IJ�����������_________��________mL��Ͳ���ձ���__________����ͷ�ιܵȡ�
�ڸ�ʵ������Ҫ��ȡ8mol•L-1��HNO3��Һ________mL��
������ʵ������е������Ƶ���ҺŨ��ƫ�ߵ���_____________��
A.ȡ8mol•L-1��HNO3��Һ��Һʱ���ӿ̶���
B.��ȡ�õ���Ͳˮϴ��δ�����κβ���
C. 8mol•L-1��HNO3��Һ����Ͳת�����ձ�����ˮϴ����Ͳ��ȫ��ת�����ձ�
D.����ʱ���ӿ̶���
E.���ݺ�����ƿ��ҡ�Ⱥ���Һ����ڿ̶��ߣ�δ�����κβ���
��5��ijͬѧת����Һ�IJ�����ͼ��ʾ����ͬѧ�����еĴ�����______________________________________������ƿ�Ŀ̶��߱��ڱȽ�ϸ��ƿ��֮�ϵ�ԭ����___________��

A.Ϊ������ B.Ϊ��ͳһ�� C.Ϊ�����ȷ�� D.����̻�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ�����и�һ��ѧ������ĩ���Ի�ѧ�Ծ��������棩 ���ͣ��ƶ���
����ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪��ɫ����X�ķֽ������ֻ��A�ǰ�ɫ���壬X��A��E��G����ɫ��Ӧ��Ϊ��ɫ��

��ش��������⣺
(1)д��X��A+B+C�Ļ�ѧ����ʽ��_____________________
(2)д��E��G�Ļ�ѧ����ʽ��_________________
(3)д��G��C��Ӧ�����ӷ���ʽ��_____________________
(4)д������Һ��X+E��A��Ӧ�����ӷ���ʽ��_________________
�������п�ͼ�ش����⣨����ʱ������ʽ�е�M��E������Ӧ��Ԫ�ط��ű�ʾ����

��ش��������⣺
��5��д��M����ϡH2SO4��H2O2���Һ�Ļ�ѧ����ʽ��________________��
��6��ijͬѧȡY����Һ������г�ȥH2O2��,��ȴ,�ټ������KI��Һ����Ϊ��ɫ��д���������KI��Һ�ķ�Ӧ�����ӷ���ʽ��_____________________��
��7��д��Cl2��Z����ΪK2EO4�Ļ�ѧ����ʽ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ����ѡ��3�����ʽṹ�����ʡ�
��һ����Ԫ�أ�selenium���ǵ������ڡ���VIA��Ԫ�أ������к����������ͻ��������л��������õĵ��ȵ����ԣ����������Ĺ��ЧӦ����Ӧ���ڹ��뵼����ϡ���ش��������⣺
��1��Seԭ�ӵĺ�������Ų�ʽΪ[Ar]_____��
��2��As��Se��ͬһ���ڵ�Ԫ�أ�As�ĵ�һ�����ܱ�Se��ԭ����______��SeO42-��Se�DO�ļ��DZ�SeO3�ļ���________�����С������
��3��H2Se��H2Sˮ��Һ������ǿ��ԭ����_____��____��
��4�������ľ���Ϊ���������ṹ��ԭ������Ϊ�������������ֲ������������ϣ�ͬһ������ԭ�����ú�ǿ��������֮��ԭ�����ý�������������״ͼ�������ṹͼ�;�������ͼ���¡�
��������Seԭ�ӵ��ӻ���ʽΪ____________��
����������CuSO4��NaOH�Ʊ���Cu��OH��2����ȩ��ʱ�����ɺ�ɫCu2O���侧���ṹ��ͼ��ʾ��
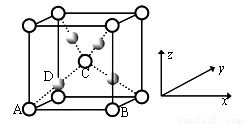
�ٸþ���ԭ���������AΪ��0��0��0����BΪ��1��0��0����CΪ��1/2��1/2��1/2������Dԭ�ӵ��������Ϊ_________��������ͭԭ�ӡ�
����Cu2O�����ܶ�Ϊd g��cm��3����������Ϊa pm�����ӵ�����ֵNA=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����c��FeCl3��=0.2 mol/L��c��FeCl2��=0.1 mol0/L�Ļ����Һ�еμ�ϡNaOH��Һ���ɵõ�һ�ֺ�ɫ��ɢϵ�����з�ɢ��������ֱ��ԼΪ9.3 nm�Ľ�������������й�˵������ȷ����
A. �÷�ɢϵ�ķ�ɢ��ΪFe2O3
B. ���ù��˵ķ�������ɫ������������Na�����뿪
C. ���ˮ����εμ�0.1mol/L FeCl3��ҺҲ�ɵõ�Fe��OH��3����
D. ����NaOHʱ�����ķ�Ӧ����Ϊ��Fe2+ +2Fe3+ +8OH�� =Fe3O4 +4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ����2���¿������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
þ���仯����һ��������Ͷ���������Ⱦ����þԭ��طŵ�ʱ��ѹ�߶�ƽ�ȣ�Խ��Խ��Ϊ����������ɫԭ��صĹ�ע���㣮����һ��þԭ��صķ�ӦΪ��xMg+Mo3S4 MgxMo3S4������˵����ȷ���ǣ�������
MgxMo3S4������˵����ȷ���ǣ�������
A. ��طŵ�ʱ��Mg2+��Ǩ��
B. ��طŵ�ʱ��������ӦΪMo3S4+2xe��+xMg2+�TMgxMo3S4
C. ��س��ʱ������������ԭ��Ӧ����Mo3S4
D. ��س��ʱ��������ӦΪxMg��2xe���TxMg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ������
CO2�Ļ������öԼ������������ŷš������������滷��������Ҫ���塣����CO2��CH4�������ƺϳ���(��Ҫ�ɷ�CO��H2)�����������в��ַ�Ӧ���Ȼ�ѧ����ʽΪ�� ��CH4(g) = C(s) + 2H2(g) ��H = +75.0 kJ��mol-1
��CO2(g) + H2(g) = CO(g) + H2O(g) ��H = +41.0 kJ��mol-1
��CO(g) + H2(g) = C(s) + H2O(g) ��H = -131.0 kJ��mol-1
��1����ӦCO2(g) + CH4(g) = 2CO(g) + 2H2(g)�ġ�H= ___________��
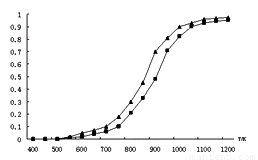
��2���̶�n(CO2)= n(CH4)���ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ���ͼ��
��ͬ�¶���CO2��ƽ��ת���� ____________(����ڡ���С�ڡ�)��CH4��ƽ��ת���ʣ���ԭ���� __________________________��
�ڸ����½��и÷�Ӧʱ������Ӧ�����ɡ���̼��(̼����)����ɴ����ж��������·�Ӧ�����Է����е�ԭ����_________________��
��3��һ��������Pd-Mg/SiO2������ʹCO2�����黯���Ӷ����Ϊ�����䷴Ӧ������ͼ��ʾ���÷�Ӧ�Ļ�ѧ����ʽΪ_____________________����Ӧ������̼Ԫ�صĻ��ϼ�Ϊ-2�۵��м�����__________��

��4��±ˮ���������̵�����CO2��ͬʱ��������ʵ���Է��ηϣ������漰��һ����Ӧ��CaSO4 + Na2CO3 == CaCO3 + Na2SO4����ﵽƽ�����Һ��c(CO32-)/c(SO42-) = __________������Ksp(CaSO4)��Ksp(CaCO3)��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵ�������Ӧ�����Ӧ���ǣ�������
A. ̼������Һ�ʼ��ԣ�������ϴȥ��м���������
B. �������ۻ������������ɻ�������Ľṹ����
C. ̿���л�ԭ�ԣ�������ұ���ơ�þ�����Ƚ���
D. Ũ�������ǿ�����ԣ������ڸ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��и�һ��ѧ�ڷְ�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ײ��ϡ��ǵ�����Ͽ�ѧ�о���ǰ�أ�1����(nm)=10-9m�����о��ɹ��㷺Ӧ���ڴ������¿�ѧ�У������ײ��ϡ���ָ�о�����������ֱ���Ӽ���������ʮ���IJ��ϣ� �罫�����ײ��ϡ���ɢ��Һ���ɢ���У����û������ܾ��е������ǣ� ��
A. �ж����ЧӦ B. ��ȫ������Ĥ
C. ��������ֽ D. ���÷�ɢϵ���ȶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com