
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g) ===2CO(g) ΔH1=—220 kJ/mol
②
下列推断正确的是
A. C(s)的燃烧热110kJ/mol
B. 2H2(g)+O2(g)===2H2O(g)ΔH1=+480kJ/mol
C. C(s)+H2O(g)===CO(g)+H2(g)ΔH1=+130kJ/mol
D. 欲分解2molH2O(l),至少需要提供4×462kJ的热量
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题:
(1)戊离子的结构示意图为________。
(2)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(3)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:__________________。
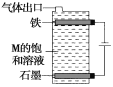
(4)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________________________。将充分电解后所得溶液逐滴加入酚酞溶液中,观察到的现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质呈黄色,常见于火山口附近。下列说法正确的是
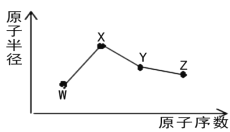
A. 氧化物的水化物酸性:Y<Z
B. 简单离子半径:W<X<Z
C. W的简单气态氢化物的沸点高于同族其它元素的简单气态氢化物
D. 将标况下等体积的Z单质与Y的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________;CH3OH的转化率为________。
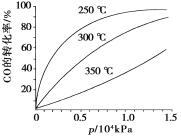
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)===CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向浓溴水中加几滴稀苯酚溶液观察沉淀
D.1 mol·L-1CuSO4溶液2 mL和0.5 mol·L-1NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下电离方程式错误的是( )
A.MgCl2=Mg2++2Cl- B.Fe2(SO4)3=2Fe3++3SO42-
C.NaHCO3=Na++H++CO32- D.NaOH=Na++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,1min内,测得υ(A)=1.2mol·L﹣1·min﹣1,则此时容器中B的物质的量是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础,是人类社会进步的里程碑。
① 下列属于复合材料的是________(填字母)。
a. 青铜 b. 玻璃钢 c. 青花瓷
② 防弹车车体外壳使用了特种合金,合金通常不具有的性质是________(填字母)。
a. 熔点高 b. 硬度大 c. 耐腐蚀
③ 为防止钢铁器件腐蚀,下列举措不合理的是________(填字母)。
a. 表面镀锌 b. 使用不锈钢 c. 表面附着铜片
(2)人的成长过程中需要食品、药物、化学元素等。
① 海参具有很高的营养价值和药用价值。含有蛋白质、油脂、氨基酸、多种维生素和丰富的钙、磷、铁等元素,其中属于人体所需微量元素的是________,油脂在人体内最终的水解产物为高级脂肪酸和________。
② 维生素C能防治坏血病并具有还原性,验证维生素C具有还原性可以使用淀粉溶液和________(填“碘水”或“碘化钾溶液”)。
③ 人体分泌胃酸过多,会使人体感到不适,此时应服消酸剂。双羟基铝酸钠[NaAl(OH)2CO3]就是一种常用的消酸剂,它和胃酸发生反应的化学方程式为
____________________。
(3)人们的生活与环境密切相关。
① 天然水中含有细小悬浮颗粒或胶体颗粒,可以用________(填一种物质的化学式)作为混凝剂净化处理。
② 废旧电池处理不当易造成____________污染,治理废水中的该物质可用沉淀法。例如:往含铅(Pb2+)废水中加入Na2S使Pb2+转化为________(填化学式)沉淀而除去。
③ 某些装修不久的居室中由装潢材料缓慢释放出来的污染物浓度过高,影响人体健康,这种污染物主要是____________(填化学式);烟道气中含有浓度较高的SO2,可用石灰乳作吸收剂,SO2最终转化生成______________(填化学式)。
④ 用二氧化碳生产化工产品,有利于二氧化碳的大量回收。CO2和H2在催化剂等条件下可以合成乙醇,该反应的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com