
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
 (2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |

- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
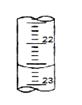
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
查看答案和解析>>
科目:高中化学 来源:2012届山西省高二上学期期末考试化学试卷 题型:实验题
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com