
ΓΨΧβΡΩΓΩΡ≥ΒΞœ©ΧΰAΘ®C8H16Θ©Ω…“‘ΖΔ…ζ»γœ¬ΆΦ ΨΒΡΉΣΜ·Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ

“―÷ΣΘΚ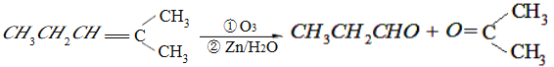
Θ®1Θ©BΒΡΖ÷Ή” ΫΈΣ___________________Θ§D÷–Κ§”–ΙΌΡήΆ≈ΒΡΟϊ≥Τ___________________ΓΘ
Θ®2Θ©BΈό“χΨΒΖ¥”ΠΘ§ D‘Ύ≈®ΝρΥα¥φ‘Ύœ¬Φ”»»Ω…ΒΟΒΫΡή ΙδεΥ°Ά …Ϊ«“÷Μ”–“Μ÷÷ΫαΙΙΒΡΈο÷ EΘ®≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ©Θ§«κ–¥≥ωΘ≈ΒΡΫαΙΙΦρ Ϋ____________________________________Θ§ΘΡΓζΘ≈ΒΡΖ¥”Πάύ–Ά___________________________ΓΘ
Θ®3Θ©–¥≥ωCΓζFΒΡΜ·―ßΖΫ≥Χ Ϋ_________________________________ΓΘ
Θ®4Θ©HΒΡΆ§Ζ÷“λΙΙΧε÷–Θ§¬ζΉψœ¬Ν–“Σ«σΒΡΫαΙΙ“ΜΙ≤”–____________÷÷Θ®≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ§Αϋά®H±Ψ…μΘ©
ΔΌ τ”ΎθΞάύΘΜΔΎΥα–‘ΧθΦΰœ¬Υ°ΫβΡήΒΟΒΫœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ74ΒΡ”–ΜζΈο
Θ®5Θ©“―÷ΣΘΚ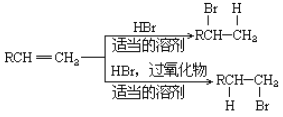 ΓΘ
ΓΘ
«κ–¥≥ω”…C÷Τ±Η2-±ϊ¥ΦΒΡΚœ≥…¬ΖœΏ_____________________Θ®ΈόΜζ‘≠Νœ»Έ―ΓΘ©ΓΘΚœ≥…¬ΖœΏΝς≥ΧΆΦ Ψάΐ»γœ¬ΘΚ![]()
ΓΨ¥πΑΗΓΩ Θ©C5H10O τ«Μυ CH3CH= CHCH2CH3 œϊ»ΞΖ¥”Π CH3CH2CHO+2AgΘ®NH3Θ©2OH![]() CH3CH2COONH4+3NH3+2AgΓΐ+H2O 16
CH3CH2COONH4+3NH3+2AgΓΐ+H2O 16 
ΓΨΫβΈωΓΩ±ΨΧβ÷ς“ΣΩΦ≤ι”–ΜζΈοΒΡΫαΙΙ”κ–‘÷ ΓΘ
Θ®1Θ©BΖ÷Ή”Κ§”–5ΗωΧΦ‘≠Ή”Θ§BΒΡΖ÷Ή” ΫΈΣC5H10OΘ§D÷–Κ§”–ΒΡΙΌΡήΆ≈ «τ ΜυΦ”«β–Έ≥…ΒΡΘ§Οϊ≥Τ «τ«ΜυΓΘ
Θ®2Θ©D «3ΓΣΈλ¥ΦΘ§Θ≈ΒΡΫαΙΙΦρ ΫΈΣCH3CH=CHCH2CH3Θ§ΘΡΓζΘ≈ΖΔ…ζ¥ΦΒΡœϊ»ΞΖ¥”ΠΘ§Ζ¥”Πάύ–ΆΈΣœϊ»ΞΖ¥”ΠΓΘ
Θ®3Θ©CΩ…”κ“χΑ±»ή“ΚΖΔ…ζΖ¥”ΠΘ§C «±ϊ»©Θ§ΘΟΓζΘΤΒΡΜ·―ßΖΫ≥Χ ΫΈΣCH3CH2CHO+2AgΘ®NH3Θ©2OH![]() CH3CH2COONH4+3NH3+2AgΓΐ+H2OΓΘ
CH3CH2COONH4+3NH3+2AgΓΐ+H2OΓΘ
Θ®4Θ©ΔΌΗΟΆ§Ζ÷“λΙΙΧε τ”ΎθΞάύΘΜΔΎΗΟΆ§Ζ÷“λΙΙΧε‘ΎΥα–‘ΧθΦΰœ¬Υ°ΫβΒΟΒΫ±ϊΥαΜρΕΓ¥ΦΓΘΒ±ΗΟΆ§Ζ÷“λΙΙΧεΈΣ±ϊΥαΈλθΞ ±Θ§”…”ΎΈλ¥Φ”–8÷÷Θ§Υυ“‘±ϊΥαΈλθΞ”–8÷÷ΘΜΒ±ΗΟΆ§Ζ÷“λΙΙΧεΈΣΕΓΥαΕΓθΞ ±Θ§”…”ΎΕΓΥα”–2÷÷Θ§ΕΓ¥Φ”–4÷÷Θ§Υυ“‘ΕΓΥαΕΓθΞ”–8÷÷ΓΘΙ≤16÷÷ΓΘ
Θ®5Θ©”…±ϊ»©÷Τ±Η÷Τ±Η2-±ϊ¥ΦΒΡΚœ≥…¬ΖœΏΘΚ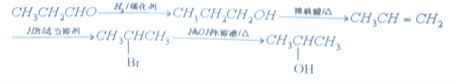 ΓΘ
ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≈δ÷Τ100 mL 1 molL©¹1«β―θΜ·ΡΤ»ή“ΚΘ§œ¬Ν–≤ΌΉς¥μΈσΒΡ «Θ® Θ©
A.‘ΎΆ–≈ΧΧλΤΫ…œΖ≈ΝΫΤ§¥σ–ΓΓΔ÷ ΝΩœύΆ§ΒΡ÷ΫΘ§»ΜΚσΫΪ«β―θΜ·ΡΤΖ≈‘Ύ÷ΫΤ§…œΫχ––≥ΤΝΩ
B.Α―≥ΤΚΟΒΡNaOHΖ≈»κ Δ”– ΝΩ’τΝσΥ°ΒΡ…’±≠÷–Θ§»ήΫβΓΔά以ȧ‘ΌΑ―»ή“Κ“Τ»κ»ίΝΩΤΩ÷–
C.”Ο’τΝσΥ°œ¥Β”…’±≠ΓΔ≤ΘΝßΑτ2ΓΪ3¥ΈΘ§œ¥Β”“Κ“≤“Τ»κ»ίΝΩΤΩ÷–
D.―ΊΉ≈≤ΘΝßΑτΆυ»ίΝΩΤΩ÷–Φ”»κ’τΝσΥ°Θ§ΒΫάκΩΧΕ»œΏ2ΓΪ3 cm ±ΗΡ”ΟΫΚΆΖΒΈΙήΒΈΦ”Θ§÷±ΒΫ»ή“ΚΑΦ“ΚΟφ«ΓΚΟ”κΩΧΕ»œΏœύ«–
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩBΓΔDΓΔCΓΔAΓΔE Έε÷÷‘ΣΥΊΒΡ‘≠Ή”–ρ ΐΥ≥–ρ“ά¥Έ‘ω¥σΘ§Τδ÷–÷Μ”–EΈΣΫπ τ‘ΣΥΊΘ§DΓΔC ‘ΣΥΊ‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΈΜ÷ΟœύΝΎΘ§‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§B ΒΡΒΞ÷ Ω…“‘Ζ÷±πΚΆAΓΔCΓΔD ΒΡΒΞ÷ Μ·Κœ…ζ≥…ΦΉΓΔ““ΓΔ±ϊΜ·ΚœΈοΘ§C ΒΡΒΞ÷ ΚΆD ΒΡΒΞ÷ Μ·ΚœΩ…ΒΟΕΓΘ§ΈλΓΔΦΚΓΔΗΐΨυΈΣΜ·ΚœΈοΓΘ“―÷Σ““ΓΔ±ϊΟΩΗωΖ÷Ή”÷–ΨυΚ§”–10 ΗωΒγΉ”Θ§œ¬ΆΦΈΣœύΜΞΉΣΜ·ΙΊœΒΘΚ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©–¥≥ωE ΒΡ‘≠Ή”ΫαΙΙ Ψ“βΆΦ_____________ΓΘ
Θ®2Θ©–¥≥ωCΓΔD «βΜ·ΈοΒΡΈ»Ε®–‘”…«ΩΒΫ»θΒΡΥ≥–ρ_________Θ®”ΟΜ·―ß Ϋ±μ ΨΘ©ΓΘ
Θ®3Θ©AΓΔBΓΔD »ΐ÷÷‘ΣΥΊ–Έ≥…ΒΡΜ·ΚœΈο÷–Τδ÷–“Μ÷÷Ω…”ΟΉςΜ·Ζ Θ§–¥ΗΟΜ·ΚœΈοΒΡΒγΉ” Ϋ__________ΓΘ
Θ®4Θ©–¥≥ωC”κ±ϊΖ¥”ΠΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ________________ΓΘ
Θ®5Θ©–¥≥ωΙΛ“Β…œ¥”ΚΘΥ°÷–÷Τ»ΓA ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ Ϋ_______________ΓΘ
Θ®6Θ©ΙΛ“Β…œΆ®Ιΐ»γœ¬ΉΣΜ·Ω…÷ΤΒΟΚ§A ‘ΣΥΊΒΡΦΊ―ΈKAO3 ΨßΧε:
NaA»ή“Κ![]() NaAO3
NaAO3![]() KAO3ΨßΧε
KAO3ΨßΧε
Δώ Δρ
ΔΌΆξ≥…Δώ÷–Ζ¥”ΠΒΡΉήΜ·―ßΖΫ≥Χ Ϋ:___________________ΓΘ
NaA+ΓθH2O![]() ΓθNaAO3+Γθ
ΓθNaAO3+Γθ
ΔΎΔρ÷–Ζ¥”ΠΙΐ≥ΧΡήΈω≥ωKClO3ΨßΧεΕχΈόΤδΥϊΨßΧεΈω≥ωΒΡ‘≠“ρ «_____________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Έο÷ ÷–Α¥’’¥ΩΨΜΈοΘ§ΜλΚœΈοΘ§ΒγΫβ÷ ΚΆΖ«ΒγΫβ÷ ΒΡΥ≥–ρ≈≈Ν–ΒΡ «
A.―ΈΥαΘ§Υ°ΟΚΤχΘ§¥ΉΥαΘ§Η…±υB.±υ¥ΉΥαΘ§―ΈΥαΘ§ΝρΥαΡΤΘ§““¥Φ
C.ΩΝ–‘ΡΤΘ§ ·Μ“ ·Θ§ΧζΘ§ΝρΥα±ΒD.Β®Ζ·Θ§Τ·ΑΉΖέΘ§¬»Μ·ΦΊΘ§¬»Τχ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΤ·ΑΉΖέ‘ΎΩ’Τχ÷–»ί“Ή ß–ßΒΡ‘≠“ρ «
A. ¥Έ¬»ΥαΗΤ≤ΜΈ»Ε®Θ§“ΉΖ÷Ϋβ B. ¬»Μ·ΗΤ“Ή≥±Ϋβ
C. ¥Έ¬»ΥαΗΤ“Ή”κ―ΈΥαΖ¥”Π D. ¥Έ¬»ΥαΗΤ“ΉΚΆΩ’Τχ÷–ΒΡΥ°ΦΑΕΰ―θΜ·ΧΦΖ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ»ΐΗωΧεΜΐΨυΈΣ0.5LΒΡΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζΖ¥”ΠΘΚCO(g)+Cl2(g)![]() COCl2(g)Τδ÷–»ίΤςΔώ÷–5min ±ΒΫ¥οΤΫΚβΓΘ
COCl2(g)Τδ÷–»ίΤςΔώ÷–5min ±ΒΫ¥οΤΫΚβΓΘ
»ίΤς±ύΚ≈ | Έ¬Ε»/Γφ | Τπ ΦΈο÷ ΒΡΝΩ/mol | ΤΫΚβΈο÷ ΒΡΝΩ/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Δώ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Δρ | 500 | 1.0 | a | 0 | 0.5 |
Δσ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. »ίΤςΔώ÷–«Α5minΒΡ÷–Ζ¥”ΠΥΌ¬ v(CO)=0.16molΓΛL-1ΓΛmin-1
B. ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”Π
C. »ίΤςΔρ÷–Τπ Φ ±Cl2ΒΡΈο÷ ΒΡΝΩΈΣ0.55mol
D. »τΤπ Φ ±Φδ»ίΤςΔώ÷–Φ”»κCO0.8molΓΔCl20.8molΘ§¥οΒΫΤΫΚβ ±COΒΡΉΣΜ·¬ ¥σ80%
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥»ή“Κ÷–Κ§MgCl2ΚΆAlCl3Ης0.01molΘ§œρΤδ÷–÷πΒΈΦ”»κ1mol/LΒΡNaOH»ή“Κ÷ΝΙΐΝΩΘ§œ¬Ν–ΙΊœΒΆΦ’ΐ»ΖΒΡ «Θ® Θ©
A.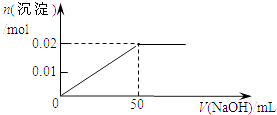
B.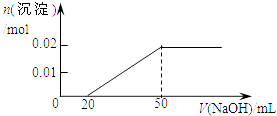
C.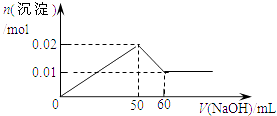
D.
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―Ι«Ω±δΜ·≤ΜΜα Ιœ¬Ν–Μ·―ßΖ¥”ΠΒΡΤΫΚβΖΔ…ζ“ΤΕ·ΒΡ « ( Θ©
A. H2(Τχ)ΘΪI2(Τχ) ![]() 2HI(Τχ)
2HI(Τχ)
B. 3H2(Τχ)ΘΪN2(Τχ) ![]() 2NH3(Τχ)
2NH3(Τχ)
C. 2SO2(Τχ)ΘΪO2(Τχ) ![]() 2SO3(Τχ)
2SO3(Τχ)
D. C(ΙΧ)ΘΪCO2(Τχ) ![]() 2CO(Τχ)
2CO(Τχ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΉ Νœœ‘ ΨΓΑO2ΒΡ―θΜ·–‘Υφ»ή“ΚpHΒΡ‘ω¥σ÷πΫΞΦθ»θΓ±ΓΘΡ≥–Υ»Λ–ΓΉιΧΫΨΩ≤ΜΆ§ΧθΦΰœ¬KI”κO2ΒΡΖ¥”ΠΘ° Β―ι»γœ¬ΓΘ
ΉΑ÷Ο | …’±≠÷–ΒΡ“ΚΧε | œ÷œσΘ®5Ζ÷÷”ΚσΘ© |
| ΔΌ2 mL1 mol/LKI»ή“Κ+5ΒΈΒμΖέ | ΈόΟςœ‘±δΜ· |
ΔΎ2 mL1 mol/LKI»ή“Κ+5ΒΈΒμΖέ+2 mL0.2 mol/L HCl | »ή“Κ±δάΕ | |
Δέ2 mL1 mol/LKI»ή“Κ+5ΒΈΒμΖέ+2 mL0.2 mol/L KCl | ΈόΟςœ‘±δΜ· | |
Δή2 mL1 mol/LKI»ή“Κ+5ΒΈΒμΖέ+2 mL0.2 mol/L CH3COOH | »ή“Κ±δάΕΘ§―’…ΪΫœΔΎ«≥ |
Θ®1Θ© Β―ιΔΎ÷–…ζ≥…I2ΒΡάκΉ”ΖΫ≥Χ Ϋ «___________ΓΘ
Θ®2Θ© Β―ιΔέΒΡΡΩΒΡ «_________________________________________________________________ΓΘ
Θ®3Θ© Β―ιΔή±»ΔΎ»ή“Κ―’…Ϊ«≥ΒΡ‘≠“ρ «________ΓΘ
Θ®4Θ©ΈΣΫχ“Μ≤ΫΧΫΨΩKI”κO2ΒΡΖ¥”ΠΘ§”Ο…œ±μ÷–ΒΡΉΑ÷ΟΦΧ–χΫχ–– Β―ιΘΚ
…’±≠÷–ΒΡ“ΚΧε | œ÷œσΘ®5–Γ ±ΚσΘ© |
Δί2 mLpH=8.5Μλ”–KOHΒΡ1mol/L KI»ή“Κ+5ΒΈΒμΖέ | »ή“Κ≤≈¬‘±δάΕ |
Δό2 mLpH=10Μλ”–KOHΒΡ1mol/L KI»ή“Κ+5ΒΈΒμΖέ | ΈόΟςœ‘±δΜ· |
IΘ°Ε‘”Ύ Β―ιΔόΒΡœ÷œσΘ°ΦΉΆ§―ßΧα≥ω≤¬œκΓΑpH=10 ±O2≤ΜΡή―θΜ·I-Γ±Θ§…ηΦΤΝΥœ¬Ν–ΉΑ÷ΟΫχ–– Β―ιΘ§―ι÷Λ≤¬œκΓΘ

iΘ°…’±≠a÷–ΒΡ»ή“ΚΈΣ____ΓΘ
iiΘ° Β―ιΫαΙϊ±μΟςΘ§¥Υ≤¬œκ≤Μ≥…ΝΔΓΘ÷ß≥÷ΗΟΫα¬έΒΡ Β―ιœ÷œσ «ΘΚΆ®»κO2ΚσΘ§_______ΓΘ
ΔρΘ°““Ά§―ßœρpH=10ΒΡKOH»ή“ΚΘ®Κ§ΒμΖέΘ©÷–ΒΈΦ”ΒβΥ°Θ§»ή“Κœ»±δάΕΚσ―ΗΥΌΆ …ΪΘ°Ψ≠Φλ≤βΆ …ΪΚσΒΡ»ή“Κ÷–Κ§”–IO3-Θ§Ά …ΪΒΡ‘≠“ρ «Θ®”ΟάκΉ”ΖΫ≥Χ Ϋ±μ ΨΘ©____________ΓΘ
Θ®5Θ©ΗΟ–ΓΉιΆ§―ßΕ‘ Β―ιΙΐ≥ΧΫχ––ΝΥ’ϊΧεΖ¥ΥΦΘ°ΆΤ≤β Β―ιΔΌΒΡœ÷œσ≤ζ…ζΒΡ‘≠“ρΩ…Ρή «______ΘΜ Β―ιΔόΒΡœ÷œσ≤ζ…ζΒΡ‘≠“ρΩ…Ρή «_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com