
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、1mol丙烯酸中含2mol双键;
C、46%的乙醇水溶液中,乙醇含有氢原子,而水也含有氢原子;
D、合成氨的反应为可逆反应,不能进行彻底.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故NA个氢氧化铁胶粒即1mol氢氧化铁胶粒中氢氧化铁的物质的量大于1mol,故质量大于107g,故A错误;
B、丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故B错误;
C、46%的乙醇水溶液中,乙醇含有氢原子,而水也含有氢原子,故含有的氢原子总数大于3NA,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故所生成的氨气分子的物质的量小于1mol,即小于NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
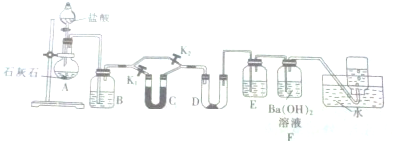
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
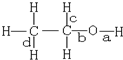
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜 | B. | 铝 | C. | 铁 | D. | 钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
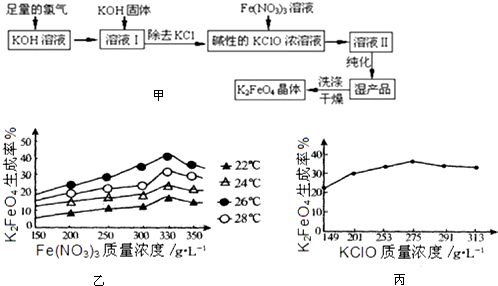
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
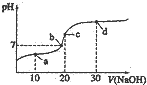 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 | A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
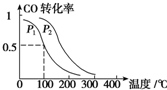 (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com