
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )

A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知25℃ 时,下列酸的电离常数: 醋酸(CH3COOH):1.75×10-5氢氰酸(HCN) :6.2×10-10,氢氟酸(HF):7.2×10-4,甲酸(HCOOH): 1.77×10-4。下列说法不正确的是( )
A. 物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是:氢氟酸
B. 物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3COOH 的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液大
C. 0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液中:c(CN-)+)
D. 等浓度的NaCN 和HCOONa 混合溶液中:c(OH-)=c(H+)+c(HCN)+c(HCOOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容基中,能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成nmolZ,同时消耗nmolY
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b 的过程如图(无机小分子产物略去)。下列说法正确的是
![]()
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有4种
D. 若R为C4H5O时,lmolb最多可以与5molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H3PO2是一元中强酸,写出其电离方程式_______________________________。NaH2PO2为__________(填“正盐”或“酸式盐”),其溶液显__________(填“弱酸性”、“中性”或“弱碱性”)
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
pH | 1~5 | 6~9 |
SO42-浓度/(mg·L-1) | ≤23000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为__________mg·L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),__________(填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是____________。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
(3)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
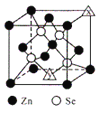
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
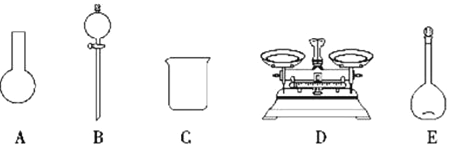
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
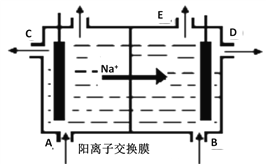
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(反应条件及部分产物已略去)。A、C、D中均含有相同的非金属元素,C、G为气体,D为淡黄色单质,I为常见强酸,反应③为化合反应。J溶液与KSCN溶液混合呈血红色。A中仅含两种元素,且元素质量比为7:8。

请回答下列问题:
(1)A的化学式为__________。
(2)H的电子式为__________。
(3)写出①的离子方程式为__________。
(4)写出②的化学方程式为____________并用单线桥标出电子转移方向和数目。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com