
【题目】AlCl3是某些有机反应的催化剂,某校学习小组用下面装置制备少量AlCl3。
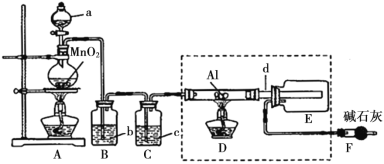
已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
(1)a仪器的名称为____________________;A装置中反应的化学方程式为_______________。
(2)试剂b为_____________________。
(3)所用d导管较粗的原因是______________________。
(4)F装置的作用为________________。
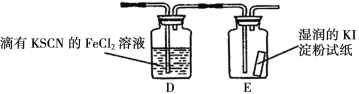
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_________;用离子方程式表示E中的现象变化_______。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 防止三氯化铝气体冷凝为固体而堵塞导管 吸收氯气防止污染空气,防止空气中的水蒸气进入 E 装置导致三氯化铝与水反应 溶液变红色 Cl2+2I- = I2+2Cl-
MnCl2+Cl2↑+2H2O 饱和食盐水 防止三氯化铝气体冷凝为固体而堵塞导管 吸收氯气防止污染空气,防止空气中的水蒸气进入 E 装置导致三氯化铝与水反应 溶液变红色 Cl2+2I- = I2+2Cl-
【解析】
根据装置A是气体发生装置制取氯气,可写出仪器a的名称和发生的化学方程式;根据浓盐酸中HCl会挥发,产生的Cl2中会含HCl气体而要除去HCl,可判断B中装的试剂b;因为AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl,装置C应装浓H2SO4干燥Cl2;根据制取的AlCl3易凝固,避免堵塞,选用粗导管;根据Cl2有毒和产物易与水反应判断F装置的作用;根据Cl2的强氧化性会氧化亚铁离子和置换出单质I2来判断;据此解答。
(1)A装置由浓盐酸与二氧化锰制备氯气,仪器a为分液漏斗,浓盐酸与二氧化锰发生氧化还原反应,生成MnCl2、Cl2、H2O,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;答案为分液漏斗,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;答案为分液漏斗,MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)生成的氯气中含有氯化氢,B用饱和食盐水除去氯气中的氯化氢;答案为饱和食盐水。
(3)由于氯化铝的熔沸点较低,因此所用d导管较粗的原因是防止三氯化铝气体冷凝为固体而堵塞导管;答案为防止三氯化铝气体冷凝为固体而堵塞导管。
(4)氯气有毒,需要尾气处理,另外空气中含有水蒸气,因此F装置的作用为吸收氯气防止污染空气,防止空气中的水蒸气进入E装置导致三氯化铝与水反应;答案为吸收氯气防止污染空气,防止空气中的水蒸气进入E装置导致三氯化铝与水反应。
(5)氯气具有强氧化性,能够将亚铁离子氧化成铁离子,因此D中溶液会变红;氯气能够将碘离子氧化成碘单质,发生反应为:Cl2+2I-=I2+2Cl-,淀粉遇到碘单质变蓝;答案为溶液变红色;Cl2+2I-=I2+2Cl-。


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
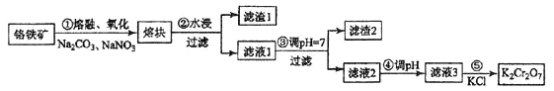
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表情包、斗图是新媒体时代的产物,微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列有关说法正确的是( )

A. A 物质与 D 物质互为同系物
B. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
C. B 物质是由的1mol 苯与3mol 氯气在光照的条件下发生取代反应而制备得到的
D. C 物质是苯的同系物,其二溴代物有7 种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】幸福可以“人工合成”吗?精神病学专家通过实验发现,人体中的一种脑内分泌物多巴胺,可影响一个人的情绪。多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐。多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
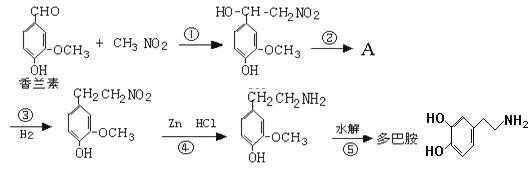
请回答下列问题:
(1)写出香兰素中含有的官能团的名称是___________________。
(2)上述合成过程中属于加成反应的是 (填反应序号)_____________。
(3)反应②的反应条件是__________。有机物A的结构简式为____________。
(4)写出符合下列条件的多巴胺的所有同分异构体的结构简式:_______________。
(i)属于1,3,5-三取代苯 (ii)苯环上直接连有一个羟基和一个氨基
(iii)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
(5)多巴胺遇足量浓溴水会产生沉淀,请写出该反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是

A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
D.如果将稀硫酸换成醋酸,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为___。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为___。
III.硫代硫酸钠(Na2S2O3)是一种重要的滴定试剂,常用来滴定溶液中的含碘量。
(7)为测定某碘水中I2的浓度(假设碘水中的碘元素均以碘单质形式存在),取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01mol·L-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,当___(填实验现象),即为终点。平行滴定3次,标准液的平均用量为20.00mL,则该碘水中I2的浓度为___mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
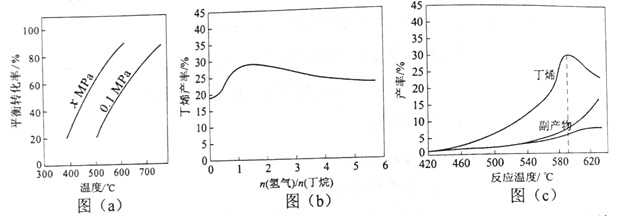
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铜丝插入Fe2(SO4)3溶液中:Cu +Fe3+ =Cu2+ +Fe2+
C. 向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经2min后,测得D的浓度为0.5molL-1,c(A):c(B)=3:4,C的平均反应速率为0.5molL-1min-1。下列说法不正确的是
A.2min后,测得A的转化率为33.3%
B.反应开始前容器中的A、B的物质的量各为4.5mol
C.2min内,用B表示的化学反应速率ν(B)=0.25molL-1min-1
D.x的值为4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com