
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 molNaOH反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】 (15分)
用于治疗精神疾病的药物半富马酸喹硫平的一仲合成路线如下所示:
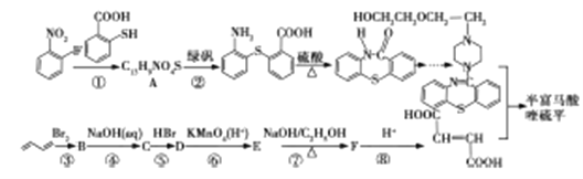
请回答下列问题:
(1)A中除硫醚键(-S-)外,还含有的官能团是______,反应③是l,3-丁二烯发生l,4-加成反应,则B的系统命名为___________。
(2)反应①~⑤中属于取代反应的有________(选填序号);流程中设计反应⑤和⑦的目的是___________________。
(3)写出反应⑦的化学方程式_____________。
(4)l,3-丁二烯分子中最多有_______个原子共平面,聚l,3-丁二烯的结构简式为__________。
(5)C的同分异构体有多种,符合下列条件的物质的结构简式为_________
① 能发生银镜反应;
② 能与NaoH溶液反应,与NaHCO3溶液不反应;
③ 核磁共振氢谱只有三组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2) i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物是溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。
已知在常温下:K(C6H5OH)=1.2×10-10 K(CH3COOH)=1.8×10-5
K(H2CO3)=4.3×10-7 K(HCO3-)=5.6×10-11 K(HCN)=4.9×10-10
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=_________;
NaHCO3+C6H5ONa的化学平衡常数K=_________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是____(填序号);
A. CuSO4
B. HCl
C. Na2S
D.NaOH
E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性
①浓度为1.0×l0-3mol.L-1的氨水bL;
②c(OH-)=1.0×10-3mol.L-l的氨水cL;
③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液dL.
则a、b、c、d之间由大到小的关系是:_________;
(4)一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1_______n2(填“>”、“<”或“=”);
(5)己知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______,此时所得混合溶液的pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族。F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 ,B、C、D三种元素的第一电离能从大到小的顺序为 。
(2)![]() 中B原子的杂化方式为 ,该离子的空间构型为________
中B原子的杂化方式为 ,该离子的空间构型为________
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式 ,化合物ABC中σ键和π键数目之比为 ,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 。
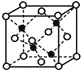
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为 ,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为 cm 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届绵阳三诊】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
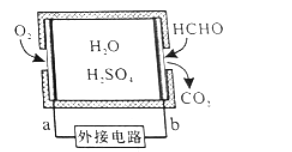
A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+==2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol电子时,传感器内参加反应的HCHO为0.75 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )
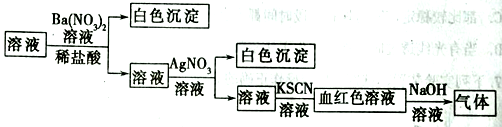
A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:
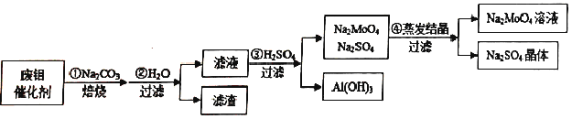
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________。
(3)第③步操作H2SO4需要适量,通常是通过_________来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________(填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com