
世界卫生组织(WHO)将ClO2 列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛的应用。ClO2属于
A.酸 B.碱 C.氯化物 D.氧化物
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
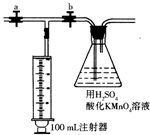
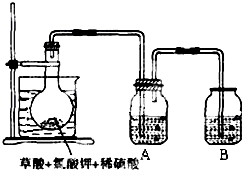 二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定.温度过高,二氧化氯的水溶液有可能爆炸.某研究小组设计如图所示实验制备ClO2.
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定.温度过高,二氧化氯的水溶液有可能爆炸.某研究小组设计如图所示实验制备ClO2.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com