
【题目】常温下,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是( )
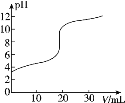
A.在滴定过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=7时,消耗NaOH溶液的体积小于20.00mL
D.在滴定过程中,随NaOH溶液滴加c(CH3COO-)持续增大
【答案】D
【解析】
A.反应后的溶液一定满足电荷守恒,根据电荷守恒分析;
B.pH=5时,溶液呈酸性,则c(H+)>c(OH),结合电荷守恒判断;
C.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL;
D.由于CH3COOH的物质的量是定值,故c(CH3COO-)不可能持续增大。
A.在反应过程中,一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.pH=5的溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),则溶液中离子浓度的大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL,故C正确;
D.由于CH3COOH的物质的量是定值,故随NaOH溶液滴加,溶液体积的增大,c(CH3COO-)不可能持续增大,故D错误;
故答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下面是第2周期部分元素基态原子的轨道表示式,据此下列说法一定错误的是( )
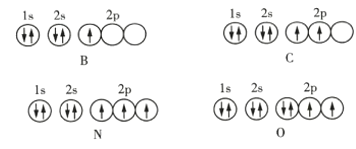
A.每个原子轨道里最多只能容纳2个电子
B.电子排在同一能级的不同轨道上时,总是优先单独占据一个轨道
C.每个电子层所具有的能级数等于该电子层序数
D.若一个原子轨道里有2个电子,则其自旋状态相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
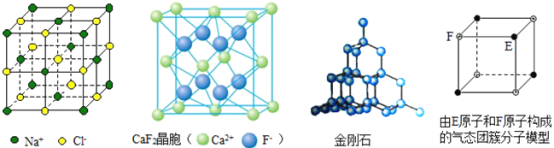
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
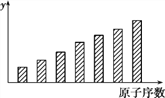
A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.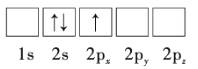
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
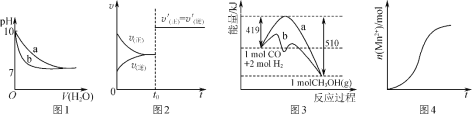
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91 kJ·mol-1
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究SO2与Cu(OH)2悬浊液的反应。
(1)实验一:用如图装置(夹持装置已略,气密性已检验)制备SO2,将SO2通入Cu(OH)2悬浊液的反应中。B中出现少量红色沉淀;稍后,B中所得溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。
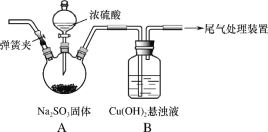
①排除装置中的空气,避免空气对反应干扰的操作是_____,关闭弹簧夹。
②打开分液漏斗旋塞,A中发生反应的方程式是_____。
(2)实验二:为确定红色固体成分,进行以下实验:
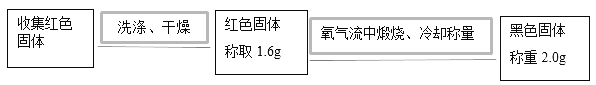
①在氧气流中煅烧红色固体的目的是_____。
②根据上述实验可得结论:该红色固体为_____。
(3)实验三:为探究B中溶液呈绿色而不是蓝色的原因,实验如下:
i.向4mL1mol/L的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ii.取少量B中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
查阅资料:SO2在酸性条件下还原性较差。
①实验i的目的_____。
②根据上述实验可得结论:溶液显绿色的原因是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol/L的CuSO4溶液中加入_____溶液,得到绿色溶液。
(4)综上实验可以得出:出现红色沉淀的原因是:_____;(用离子方程式表示)溶液呈现绿色的原因是:_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率Al-H2O2动力电池(如图),下列说法不正确的是

A. H2O2 在碳电极上发生还原反应
B. 碳电极附近溶液的pH增大
C. 溶液中OH-向负极移动
D. 负极反应式为Al-3e-+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A.向硝酸银溶液中加盐酸Ag++C1-=AgCl↓
B.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
C.盐酸跟氢氧化镁反应:H++OH-=H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com