
(14分)Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是 。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为 。
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
![]()
(4)若反应中浓H2SO4过量,则 产物中无X生成,请完成此化学反应方程式: 。
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
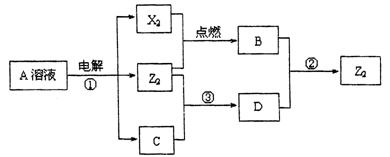
(1)Y在周期表的位置是 ;
(2)反应①的化学方程式是 。
(3)D溶液呈碱性的原因是(用离子方程式表示) 。
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。
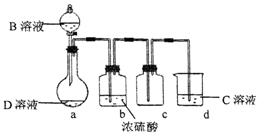
(4)写出反应②的离子方程式 。
(5)上述实验装置不够完善,改进方法是 。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z
2Z 2Z
2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
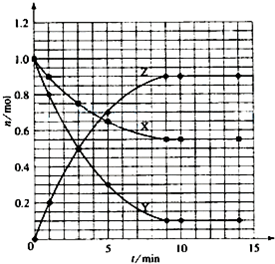

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?盐城一模)[实验化学]
(2013?盐城一模)[实验化学]
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com