
����Ŀ��ij��ɫ��Һ�п��ܺ���Mg2+��Ba2+��Cl-��HCO3-�е�һ�ֻ������ӡ�Ϊȷ����ɷ֣���������ʵ�飺
ʵ��1��ȡl0mL��ɫ��Һ���μ�����ϡ��������������
ʵ��2����ȡl0mL��ɫ��Һ������������Na2SO4��Һ���а�ɫ�������ɡ�
ʵ��3����ʵ��l�����Һ����ƿ�У�����ƿ����μ���NaOH��Һ���μӹ����в������������������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ��
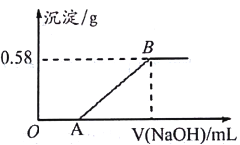
�ش��������⣺
��1��ԭ��Һ�в����ڵ�������________�����ڵ�������___________________��
��2��ʵ��3�У�ͼ����OA�η�Ӧ�����ӷ���ʽΪ___________________��
��3������ͼ�����ԭ��Һ��Mg2+�����ʵ���Ũ��______________����д��������̣�
���𰸡� HCO3- Mg2+��Ba2+��Cl- H++OH-= H2O 1 mol/L
��������ʵ��1��ȡl0mL��ɫ��Һ���μ�����ϡ��������������˵��ԭ��Һ�в�����HCO3-��ʵ��2����ȡl0mL��ɫ��Һ������������Na2SO4��Һ���а�ɫ�������ɡ�˵����Һ����Ba2+��ʵ��3����ʵ��l�����Һ����ƿ�У�����ƿ����μ���NaOH��Һ���μӹ����в������������������NaOH��Һ������Ĺ�ϵͼ��������ʼ����˵����Һ����H+���ٲ����˳�����˵����Һ���� Mg2+������Һ�ʵ����ԣ���Һ��һ����������Cl-��
��1��ԭ��Һ�в����ڵ�������HCO3-�����ڵ�������Mg2+��Ba2+��Cl- ����2��ʵ��3�У�ͼ����OA���к���Һ��H+����Ӧ�����ӷ���ʽΪH++OH-= H2O����3������ͼ�����ԭ��Һ��Mg2+�����ʵ���Ũ��Ϊ��n(Mg(OH)2)=0.58g/58g��mol��1=0.01mol,c(Mg2��)=0.01mol/0.01L=1mol��L��1��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������У�SO2�ڽӴ����б�������ΪSO3���壬��֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98.3 kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����
A��2SO2(g)��O2(g)![]() 2SO3(g) ��H=��196.6 kJ��mol��1
2SO3(g) ��H=��196.6 kJ��mol��1
B��2SO2(g)��O2(g)![]() 2SO3(g) ��H=��98.3 kJ��mol��1
2SO3(g) ��H=��98.3 kJ��mol��1
C��SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H=+98.3 kJ��mol��1
SO3(g) ��H=+98.3 kJ��mol��1
D��SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H=��196.6 kJ��mol��1
SO3(g) ��H=��196.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(At)��±��Ԫ����λ�ڵ���Ԫ�أ��Ʋ��������Ļ���������ܾ߱���������(����)
A. ��������ijЩ�л��ܼ� B. ��������ȶ����ֽ�
C. ������ɫ���� D. ������������ˮ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ӷ���ʽ�У�����ˮ�ⷴӦ���ǣ� ��
A.HS-+H2OH2S+OH-B.HCO3-+H2OH3O++CO32-
C.HCO3-+OH-�TCO32-+H2OD.NH3+H2OOH-+NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. Ԫ�����ڱ���Ԫ�������������ԭ�ӵĺ˵����
B. Ԫ�����ڱ���ʮ�������У�Ҳ����ʮ������
C. ԭ�ӵ�������������ͬ��Ԫ�أ�һ������ͬһ��
D. ���Ӳ�����ͬ�����ӣ���ӦԪ��һ������ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�ij����ȼ�ϵ��(BFC)���Ҵ�Ϊȼ�ϣ�ֱ�ӻ�������ø�����������ܷ�ӦΪC2H5OH+302![]() 2C02+3H20,�乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
2C02+3H20,�乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
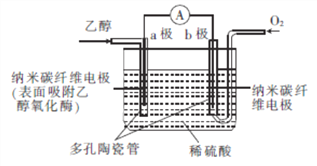
A. �Ҵ�������ԭ��Ӧ
B. b���ϵĵ缫��ӦʽΪO2+4e-+H2O=4OH-
C. ��ع���ʱ�����Һ�е�H+��a����b��Ǩ��
D. �����·����1.2 mol����ת��ʱ���ܲ���4.48 L CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǻϳ�����ҩ����������Ҫ�м��壬�Ա���Ϊԭ���Ʊ���������ĺϳ�·����ͼ��ʾ��
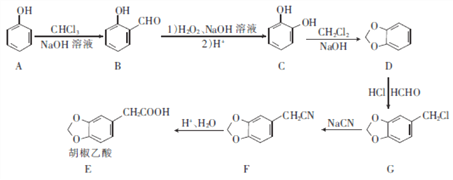
�ش��������⣺
��1�����й����л���B��˵����ȷ���� ____________(����ĸ����
a.����FeCl3��Һ������ɫ��Ӧ
b.�˴Ź���������ֻ��3���
c.�ܷ���������Ӧ
d.������ˮ�����ӳɷ�Ӧ
��2��C��������___________��C D�ķ�Ӧ������_______��
��3����������(E)�����������ŵ�����Ϊ __________ ��
��4��G����F�Ļ�ѧ����ʽΪ_____________��
��5��W��E��ͬ���칹�壬0.5 mol W������̼��������Һ��Ӧ����1 mol C02����֪W�ı�����ֻ��2��ȡ��������W�Ľṹ����__________(���������칹)�֣����к˴Ź��������������Ľṹ��ʽΪ_______��
��6�����������ϳ�·�ߣ�д����һ�ȼױ���![]() ��Ϊԭ�ϣ����Լ���ѡ���Ʊ�������ĺϳ�·�ߣ�____________________
��Ϊԭ�ϣ����Լ���ѡ���Ʊ�������ĺϳ�·�ߣ�____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O(Ц��)��CHCl3(�ȷ�)������ҽѧ�ϱ�����������������˵����ȷ����
A. N2O��CHCl3��������ˮ B. N2O��CHCl3�������¶�������
C. N2O��CHCl3������������� D. N2O��CHCl3���Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҹ�����һ��˫����ȼ�ϵ�أ��Ա���(QH60)Ϊȼ�ϣ�ͬʱ�������Է�ˮ�е������Ρ�����˵����ȷ����:�� ��
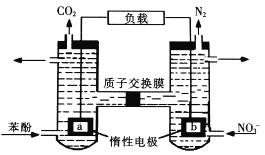
A. a����
B. ���ҳز���0. 672L����(����£�����ת�Ƶ���0.15mol
C. ��ص缫��ӦʽΪ C6H6O+11H2O-28e-=6CO2��+28H+
D. ������ĵı������ҳ����ĵĵ����ʵ���֮��Ϊ�e28:5
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com