
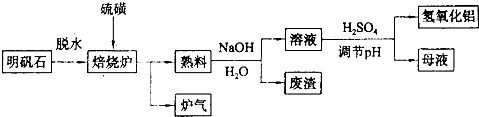
| ||
| 3 |
| 2 |
| 1.12L |
| 22.4L/mol |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
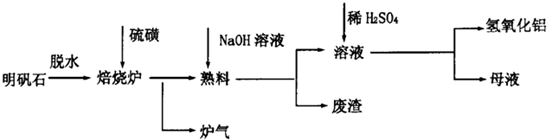
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
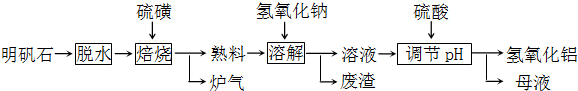
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市通州区高三重点热点专项检测化学试卷 题型:填空题
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
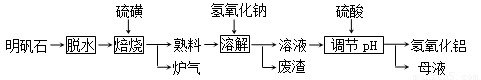
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3 +9SO2 ,其中氧化剂为 。
2Al 2O3 +9SO2 ,其中氧化剂为 。
(2)“溶解”时反应的离子方程式为 。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com