
根据所学知识填表(其中“构成物质的微粒”用化学式表示,“化合物类型”一列填“离子化合物”或者“共价化合物”):
序号 | 物质 | 构成物质的微粒 | 化学键类型 | 化合物类型 |
1 | H2O | |||
2 | Na2O | |||
3 | NH3 | |||
4 | CO2 | |||
5 | Na2SO4 | |||
6 | NaOH | |||
7 | KCl | |||
8 | H2O2 |
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

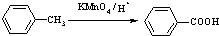
 (苯胺,易被氧化)
(苯胺,易被氧化)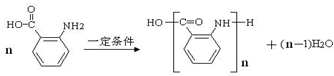


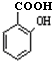 (水杨酸)有多种同分异构体,写出符合下列条件的结构简式
(水杨酸)有多种同分异构体,写出符合下列条件的结构简式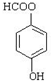

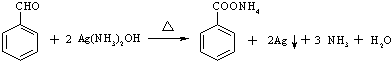
 和其他无机物合成
和其他无机物合成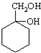 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com