
下列措施或事实不能用勒夏特列原理解释的是()
A. 新制的氯水在光照下颜色变浅
B. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. H2、I2、HI平衡混合气加压后颜色变深
考点: 化学平衡移动原理.
专题: 化学平衡专题.
分析: A、氯水中存在平衡Cl2+H2O HClO+H++Cl﹣,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动.
HClO+H++Cl﹣,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动.
B、Fe(SCN)3溶液中存在平衡Fe3++SCN﹣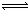 Fe(SCN)2+(红色),加入NaOH溶液,发生反应Fe3++OH﹣=Fe(OH)3,溶液中Fe3+浓度降低,平衡向生成Fe3+的方向移动.
Fe(SCN)2+(红色),加入NaOH溶液,发生反应Fe3++OH﹣=Fe(OH)3,溶液中Fe3+浓度降低,平衡向生成Fe3+的方向移动.
C、合成氨反应为N2(g)+3H2(g)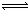 2NH3 (g)△H<0,正反应为气体体积减小的放热反应,降低温度平衡向放热反应移动,增大压强平衡向体积减小的方向移动.
2NH3 (g)△H<0,正反应为气体体积减小的放热反应,降低温度平衡向放热反应移动,增大压强平衡向体积减小的方向移动.
D、可逆反应为H2(g)+I2(g)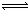 2HI(g),反应前后气体的体积不发生变化,增大压强平衡不移动.
2HI(g),反应前后气体的体积不发生变化,增大压强平衡不移动.
解答: 解:A、氯水中存在平衡Cl2+H2O HClO+H++Cl﹣,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,故A正确;
HClO+H++Cl﹣,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,故A正确;
B、Fe(SCN)3溶液中存在平衡Fe3++SCN﹣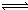 Fe(SCN)2+(红色),加入NaOH溶液,发生反应Fe3++OH﹣=Fe(OH)3,溶液中Fe3+浓度降低,平衡向生成Fe3+的方向移动,可用勒夏特列原理解释,故B正确;
Fe(SCN)2+(红色),加入NaOH溶液,发生反应Fe3++OH﹣=Fe(OH)3,溶液中Fe3+浓度降低,平衡向生成Fe3+的方向移动,可用勒夏特列原理解释,故B正确;
C、合成氨反应为N2(g)+3H2(g)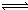 2NH3 (g)△H<0,正反应为气体体积减小的放热反应,降低温度平衡向放热反应移动,增大压强平衡向体积减小的方向移动,即向正反应移动,有利于氨的合成,可用勒夏特列原理解释,故C正确;
2NH3 (g)△H<0,正反应为气体体积减小的放热反应,降低温度平衡向放热反应移动,增大压强平衡向体积减小的方向移动,即向正反应移动,有利于氨的合成,可用勒夏特列原理解释,故C正确;
D、可逆反应为H2(g)+I2(g)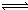 2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,不能用用勒夏特列原理解释,故D错误.
2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,不能用用勒夏特列原理解释,故D错误.
故选:D.
点评: 本题考查了勒夏特利原理、平衡移动等,难度中等,注意改变压强的实质是改变体积,影响反应混合物的浓度.


科目:高中化学 来源: 题型:
把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为 ( )
A. 2mol B. 3mol C. 4mol D. 5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的CuSO4起反应.在该反应中,铁是()
①氧化剂;②还原剂;③被氧化;④被还原.
A. ①③ B. ①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是()
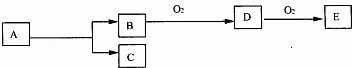
A. AlCl3 B. H2O2 C. KCl D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是 (填代号).
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I﹣氧化为I2:S2O82﹣+2I﹣=2SO42﹣+I2.
通过改变反应途径,Fe3 +、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是 .
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 .证明炉渣中含有FeO的实验现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,AgCl(s)⇌Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是()

A. 加入AgNO3,可以使溶液由c点变到d点
B. 加入少量水,平衡右移,Cl﹣浓度减小
C. d点没有AgCl沉淀生成
D. c点对应的Ksp等于a点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学式为 .
已知:CO(g)+1/2O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;S(s)+O2=SO2(g)△H=﹣296.0kJ•mol﹣1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)⇌2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.
则T1>T2(填“>”“<”),甲容器中反应的平衡常数K= .
(3)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)⇌2NH3(g),起始时A、B的体积相同均为a L.
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)= .
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为 (用c1、c2、c3和>、<、=表示).已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,则该温度下0.1mol•L﹣1的NH4Cl溶液的pH为 .

查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上12月月考化学试卷(解析版) 题型:选择题
如下图表示4-溴环己烯所发生的4个不同反应,其中,产物只含有一种官能团的反应是
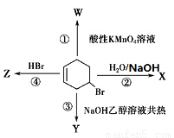
A.①④ B.③④ C.②③ D.①②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:填空题
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com