
Al可以与稀硝酸反应,已知HNO3被还原为N2O。若标准状况有3.36LN2O生成。则参加反应的铝的质量(g)为( )
A. 27 B. 5.4 C. 10.8 D. 16.2
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:简答题
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1mol•L-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
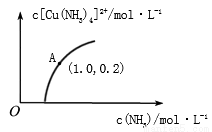
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:简答题
氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
Zn2+基态核外电子排布式为______________,其核外存在______________对自旋相反的电子。
写出两个与水分子具有相同空间构型的分子和阴离子:__________,____________。
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________(填序号)。
A、氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变
C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变
在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJ mol-1,除氢键外,水分子间还存在范德华力(11kJ
mol-1,除氢键外,水分子间还存在范德华力(11kJ mol-1),则冰晶体中氢键的键能是___________kJ
mol-1),则冰晶体中氢键的键能是___________kJ mol-1。
mol-1。

氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是______________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是______________;该晶体的化学式为______________。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由:__________________________。
某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为_______________,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度:____________g cm-3(不必计算结果)。
cm-3(不必计算结果)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
我国学者成功发现了新一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出深蓝色钨氧化物(WO2.9),该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是( )

A. WO3和WO2.9是同分异构体
B. 由WO3制备WO2.9的过程发生了氧化还原反应
C. 18gH2O在WO2.9的高效催化下产生H2体积为22.4L
D. 利用这种新型催化剂分解水的同时可放出热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3∶2∶2,则三种溶液的溶质的物质的量浓度之比为( )
A. 3∶4∶2 B. 2∶3∶3 C. 6∶3∶1 D. 2∶3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列选项中,符合右图所示关系的是( )

A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系
C. 100℃,1个大气压下,按体积比1∶1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系
D. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
能与Al反应生成H2的透明溶液中可能大量共存的一组离子是( )
A. K+、NO3-、AlO2-、Na+ B. NH4+、SO42-、CO32-、NO3-
C. Mg2+、Fe3+、Cl-、SCN- D. K+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:填空题
硼及其化合物在工农业生产中应用广泛。
(1)基态硼原子的核外电子排布式为__________,有_______种不同能量的电子。
(2)BF3溶于水后.在一定条件下可转化为H3O+·[B(OH)F3]-,该物质中阳离子的空间构型为_____________,阴离子的中心原子轨道采用________杂化。
(3)与BH4-互为等电子休的分子是_______________(写化学式)。
(4)EminBF4的熔点为12 ℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]-构成。该物质的晶体属于_________晶体。
(5)一种由硼和钐(Sm)形成的晶体的晶胞结构如图所示,已知晶胞常数a=n pm,则晶体的密度为_____________g·cm-3(设NA为阿伏伽德罗常数的值)。
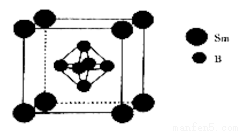
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三第三次联考理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为___________。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中):
①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式_____________。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00ml,判断达到滴定终点的方法是_________。该水样中ClO2的浓度是___mg/L。
(3)某学习小组设计如下装置进行制取亚氯酸钠(NaClO2)。
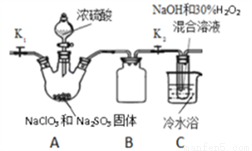
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式为_______。将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。
②装置B的作用是____________。
③某同学认为上述装置并不完整,请画出需补充的装置图____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com