
【题目】反应:3A(g)+B(g) = 2C(g) +2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol/(L·min) ②v(B)=0.45 mol/(L·min)
③v(C)=0.015 mol/(L·min) ④v(D)=0.45 mol/(L·min)
则此反应在不同条件下进行最快的是( )
A.①B.②C.③D.④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:______ min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是______ (填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图。
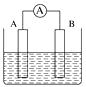
①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的正极反应式:_______。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:______;该电池在工作时,A电极的质量将______(填“增加”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法中正确的是
A.卢瑟福根据![]() 粒子散射现象提出“葡萄干面包式”的原子结构模型
粒子散射现象提出“葡萄干面包式”的原子结构模型
B.原子中,核对核外电子吸引作用实质是核内的质子对核外电子的吸引
C.质子数决定元素的种类,中子数决定核素的种类
D.所有的原子都含有质子、中子和电子3种基本粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0°C | 0.5 molL1稀硫酸 | 4 min 左右出现蓝色 |
② | 20°C | 1 min 左右出现蓝色 | ||
③ | 20°C | 0.1 molL1稀硫酸 | 15 min 左右出现蓝色 | |
④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________。
(2)写出实验③中 I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。
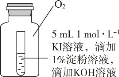
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的 pH | 8 | 9 | 10 | 11 |
放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
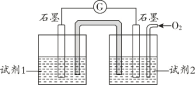
试剂1______________。 试剂2______________。实验现象:___________________________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴 70°C | 5 mL 1 molL1 KI 溶液 5 mL 0.5 molL1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________(写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,无法达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中少量的KNO3杂质 | 将固定溶于水配成溶液,蒸发结晶并趁热过滤 |
B | 检验乙酸乙酯中是否含有乙酸 | 加入含有酚酞的NaOH溶液并振荡,观察下层溶液颜色变化 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
D | 比较Fe3+和I2的氧化性强弱 | 向含有淀粉的KI溶液中滴入FeCl3溶液,观察溶液颜色变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。我们可以通过实验来探究绿矾的某些性质。
(1)观察绿矾样品,可以发现其呈蓝绿色:在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,说明该溶液中______________,即绿矾没有变质。将上述溶液分在两支试管中,向一支试管加入少量稀硫酸,再通入空气,溶液逐渐变红,发生反应的离子方程式为______________;如果不加稀硫酸,通入空气观察到的现象为_________。向另一支试管中滴加BaCl2溶液,观察到的现象为____;
(2)可以通过下图装置来测定绿矾中结晶水的含量。
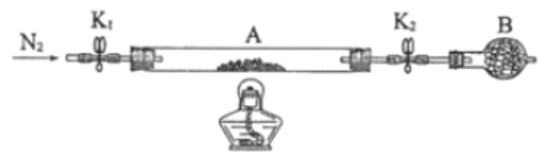
将石英玻璃管A (两端带开关K1和K2)称重,记为m1g。将样品装入石英玻璃管中,再次将装置 A称重,记为m2g。按图连接好装置进行实验。
①仪器B的名称是____________。
②将下列实验操作步骤正确排序____________(填标号)重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____________(列式表示)。若实验时按照a、d次序操作,则使x=____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物SO2、CH3OH与H2O之间的反应,有利于揭示雾霾的形成机理。
反应i:![]()
反应ii:![]()
(1)CH3OSO3H发生水解:![]() △H=______kJ/mol。
△H=______kJ/mol。
(2)T℃时,反应ii的CH3OH(g)、SO3(g)的初始浓度分别为![]() ,平衡时SO3转化率为0.04%,则K=_____________。
,平衡时SO3转化率为0.04%,则K=_____________。
(3)我国科学家利用计算机模拟计算,分别研究反应ii在无水和有水条件下的反应历程,如图所示,其中分子间的静电作用力用“…”表示。
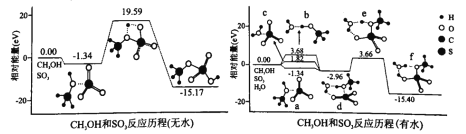
①分子间的静电作用力最强的是_____________(填“a”、“b”或“c”)。
②水将反应ii的最高能垒由_____________eV降为_____________eV。
③d到f转化的实质为质子转移,该过程断裂的化学键为____(填标号)。
A.CH3OH中的氢氧键B.CH3OH中的碳氧键
C.H2O中的氢氧键D.SO3中的硫氧键
(4)分别研究大气中H2O、CH3OH的浓度对反应i、反应ii产物浓度的影响,结果如图所示。
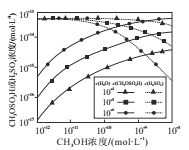
①当c(CH3OH)大于10-11mol.L-1时,c(CH3OH)越大,c(H2SO4)越小的原因是_____________。
②当c(CH3OH)小于10-11mol.L-1时,c(H2O)越大,c(CH3OSO3H)越小的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )
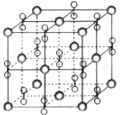
A. 晶体中与每个K+距离最近的O2-有6个
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. KO2中阴、阳离子个数比为1:2
D. 晶体中所有原子之间都以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,Y原子是最轻的原子,人们曾预言它可能是所有元素之母。
(1)X基态原子的电子排布式为___。
(2)C、H、O、N四种原子的电负性由大到小的顺序为___。
(3)Y负离子基态电子排布式为___。
(4)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子的第一电离能为__。
(5)水溶液中有H3O+、H5O![]() 、H9O
、H9O![]() 等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O
等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O![]() 的结构式:__。
的结构式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com