
【题目】室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与![]() 的变化关系如图所示。下列说法正确的是( )
的变化关系如图所示。下列说法正确的是( )
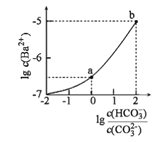
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
A.a对应溶液的pH小于b
B.b对应溶液的c(H+)=4.2×10-7mol·L-1
C.a→b对应的溶液中![]() 减小
减小
D.a对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
【答案】D
【解析】
a点横坐标为0,即lg![]() =0,所以
=0,所以![]() =1,b点lg
=1,b点lg![]() =2,
=2,![]() =100;另一方面根据HCO3-
=100;另一方面根据HCO3-![]() H++CO32-可得:K a2=
H++CO32-可得:K a2=![]() ,据此结合图像分析解答。
,据此结合图像分析解答。
A.由分析可知,K a2=![]() ,而a点
,而a点![]() =1,所以a点有:c(H+)= Ka2=5.6×10-11,同理因为b点
=1,所以a点有:c(H+)= Ka2=5.6×10-11,同理因为b点![]() =100,结合K a2表达式可得5.6×10-11=
=100,结合K a2表达式可得5.6×10-11=![]() ,c(H+)=5.6×10-9,可见a点c(H+)小于b点c(H+),所以a点pH大于b点,A错误;
,c(H+)=5.6×10-9,可见a点c(H+)小于b点c(H+),所以a点pH大于b点,A错误;
B.由A可知,b点c(H+)=5.6×10-9,B错误;
C.由K a2=![]() 和KW的表达式得:K a2=
和KW的表达式得:K a2=![]() ,温度不变,K a2、Kw均不变,所以
,温度不变,K a2、Kw均不变,所以![]() 不变,C错误;
不变,C错误;
D.根据电荷守恒有:2c(Ba2+)+c(Na+)+c(H+)=c(HCO3-)+c(Cl-)+c(OH-)+2 c(CO32-),a点c(HCO3-)=c(CO32-)代入上面式子得:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-),D正确。
答案选D。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型光催化剂Zn2GeO4具有较高的催化活性。下列有关其组成元素的说法正确的是( )
A.Zn处于元素周期表中的d区
B.Ge的价电子排布式为3d104s24p2
C.基态O原子中成对电子数是未成对电子数的2倍
D.三种元素电负性由大到小的顺序是:O>Ge>Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成一种新化合物(如图所示)。

其中W、X、Y、Z为同周期元素,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X核外电子数的一半。
回答下列问题:
(1)W、X、Y、Z原子半径由大到小的顺序为__(用对应的元素符号表示)。
(2)Z的核外电子排布式为__。
(3)基态X原子价电子轨道表示式为__。
(4)W元素基态原子核外电子有__种运动状态,其中电子占据能量最高的原子轨道符号表示为__。
(5)X的电负性__(填“大于”或“小于”)Y,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO42H2O)可制造阻燃剂和无公害型冷水系统的金属抑制剂。由钼精矿(主要成分MoS2,含有少量不反应杂质)制备钼及钼酸钠晶体的工艺流程如下:

(1)焙烧时,下列措施有利于使钼精矿充分反应的是________(填序号)。
a 增大钼精矿的量 b 将矿石粉碎 c 采用逆流原理混合
(2)操作1的名称是______,“碱浸”过程中反应的离子方程式为________。
(3)经“蒸发结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,需要进行的操作2名称是_________。
(4)Mo元素有+4、+6两种价态,钼精矿中存在非整比晶体MoS2.7,则MoS2.7中Mo4+所占Mo元素的物质的量分数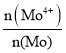 为__________。
为__________。
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。图像中纵坐标x =_____。
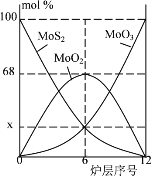
(6)在实际生产中会有少量SO42-生成,用固体Ba(OH)2除去。在除SO42-前测定碱浸液中c(MoO42-)=0.80mol·L-1, c(SO42-)=0.04mol·L-1,当BaMoO4开始沉淀时,SO42-的去除率为94.5%,则Ksp(BaMoO4)=_________。[ Ksp(BaSO4)= 1.1×10-10,溶液体积变化、温度变化可忽略。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:CO+2H2![]() CH3OH(g)。该可逆反应达到平衡的标志是________。
CH3OH(g)。该可逆反应达到平衡的标志是________。
A.2 v正(H2)= v逆(CH3OH)
B.单位时间生成m molCO的同时生成2m molH2
C.容器内气体的平均相对分子质量不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取化工原料气氢气,某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10min内,CO的物质的量减少的原因可能是____________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容器密闭容器中同时充入0.2molCH4、0.62molH2O、a molCO和0.5molH2,当a =0.2时,上述反应向_____(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
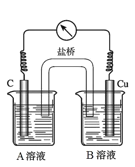
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com