
在密闭容器中,对已达到化学平衡的反应: (正反应为放热反应),其他条件不变,则下列说法正确的一组是
(正反应为放热反应),其他条件不变,则下列说法正确的一组是
①恒温恒容条件下,充入不参与反应的气体He,平衡不移动,各种气体的体积分数不变
②恒温恒压条件下,充入不参与反应的气体He,平衡正向移动,则可知x>3
③恒容条件下,给体系升温,正反应速率和逆反应速率都增大,逆反应速率增大得多些
④恒容条件下,给体系降温,混合气体的平均相对分子质量一定增大
⑤改变某一条件,使平衡正向移动,则反应物A的转化率一定增大
⑥加压压缩容器体积,平衡先逆向移动,后又正向移动,则C或D至少有一种变为非气态
⑦改变某一条件,只要平衡正向移动,则逆反应速率一定减小
| A.①③⑤ | B.②④⑥ | C.②③⑥ | D.③⑤⑦ |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:“伴你学”新课程 化学2必修(鲁科版) 题型:013
|
对一定条件下,在密闭容器中已达平衡状态的可逆反应:NO2+CO | |
| [ ] | |
A. |
从开始反应至达到平衡状态,容器内压强始终保持不变 |
B. |
在到达平衡时,NO2、CO2、NO、CO的物质的量均相等 |
C. |
平衡体系中气体总的物质的量等于开始反应时体系中气体总的物质的量 |
D. |
达到平衡时,NO和CO2的物质的量之和可能等于NO2和CO的物质的量之和 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
实验次数 起始浓度/(mol/L) 反应条件
A B C 温度/℃ 压强/Pa 催化剂
① 1 5 0 200 1.01´106 有
② 1 5 0 200 1.01´106 有
③ 1 1 0 200 1.01´105 有
④ 1 5 0 20 1.01´105 无
⑤ 1 1 0 20 1.01´105 无
根据上表提供数据判断,当反应达平衡时:
(1)第________次实验结果,A已转化的最多;
(2)第________次实验结果,A的浓度最大;
(3)第________次实验结果,正反应速率最大。
查看答案和解析>>
科目:高中化学 来源:2010年重庆市南开中学高三10月月考(理综)化学部分 题型:填空题
(14分)在密闭容器中进行如下反应:3m A(g)+m B(g) n C(g)+q D(s)。
n C(g)+q D(s)。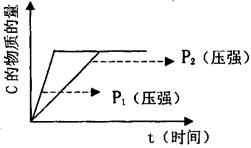
(一)
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1 P2(填“>”、“<”或“=”);m与n之间的关系为: (用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有 。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因: 。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____ (用含有W%的代数式表示,下同),平衡时C的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(解析版) 题型:填空题
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH 是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g)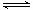 CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
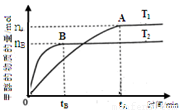
①通过分析上图,可以得出对反应CO2(g)+3H2(g)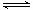 CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
A.该反应为放热反应
B.T1时的反应速率大于T2时的反应速率
C.该反应在T1时的平衡常数比T2时的大
D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大
②下列情形能说明上述反应已达到平衡状态的是 (填序号)
a.体系压强保持不变 b.v(H2)=3v(CO2)
c.CH3OH与H2物质的量之比为1:3 d.每消耗1 mol CO2的同时生成3molH2
e.密闭容器中混合气体的密度不变 f.密闭容器中CH3OH的体积分数不变
③在T1温度时,将2molCO2和6molH2充入该密闭容器中,充分反应达平衡时,若CO2的转化率为60%,则容器内的压强与起始压强之比为 ,该反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:3m A(g)+m B(g)![]() n C(g)+q D(s)。
n C(g)+q D(s)。
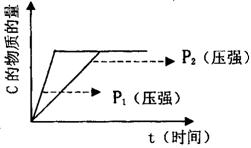
(一)
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1 P2(填“>”、“<”或“=”);m与n之间的关系为: (用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有 。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因: 。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____ (用含有W%的代数式表示,下同),平衡时C的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com