
(10分)工业上通常把溶液中存在的CO32- 和HCO3-的总浓度称为总碱度。水中碱度的控制成为碳酸钠软化水处理法的关键。碳酸在水中一般以3种形态存在,即H2CO3(CO2)、CO32- 和HCO3-。当溶液的pH发生变化时,其中任一种形态的物质的量占三种形态总物质的量的分数δ也可能发生变化,下图是碳酸溶液中碳酸的各种形态的δ随pH的变化曲线。
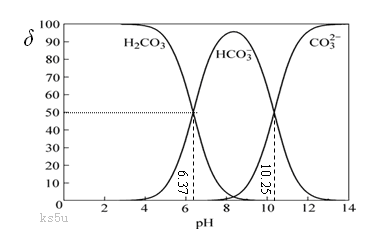
(1)从图中推断NaHCO3溶液呈 (填“酸”、“碱”、或“中”)性,其原因是
(用离子方程式表示)。
(2)正常情况下,人体血液的pH维持在7.35~7.45之间,则溶于血液中的二氧化碳的主要存在形式是 。(填写微粒化学式)
(3)根据上图,下列叙述中正确的是 。
A.HCO3-既能与强酸反应又能与强碱反应。
 B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
C.pH小于7的雨水称为酸雨
D.在pH为6.37时,溶液中的c (H2CO3)= c (HCO3-)
(4)工业用循环冷却水中常含有Ca2+等杂质离子,在循环过程中易结垢,可通过控制溶液的总碱度使Ca2+等离子形成沉渣除去。已知某温度下Ksp(CaCO3)=3.03×10-9,当水中的c(Ca2+)≤3×10-4 mol·L-1时,不会出现结垢现象,则该水中的c(CO32-)应至少为 mol·L-1。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江苏省通州市石港中学2008届高三化学科押宝卷 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省肇庆市怀集一中高三(上)月考化学试卷(10月份)(解析版) 题型:填空题
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com