
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

| 浓H2SO4 |
| △ |


 ;
; ;(
;(

科目:高中化学 来源: 题型:阅读理解
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
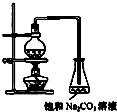 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
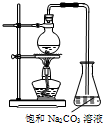 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
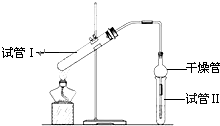 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 |
0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com