
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
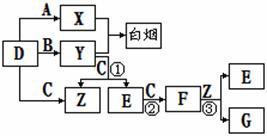
请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届宁夏银川一中高三第三次模拟考试化学试卷(带解析) 题型:填空题
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(带解析) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
 ,违背了 原理。
,违背了 原理。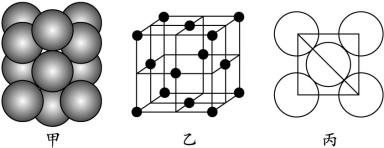
查看答案和解析>>
科目:高中化学 来源:2011-2012学年宁夏高三第三次模拟考试化学试卷(解析版) 题型:填空题
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
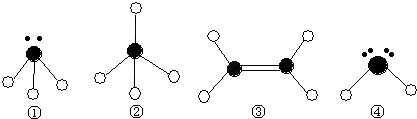
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图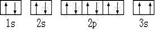
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
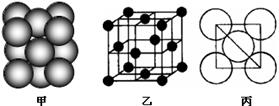
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出②中盐的水溶液显酸性的原因(写出离子方程式)_____________________;
(2)已知A、B、C、D可组成原子个数比5∶1∶1∶3的化合物,写出该化合物与足量NaOH溶液反应的离子方程式:__________________________。
(3)“长征2号”运载火箭所用燃料就是C的氢化物被取代后的产物(相对分子质量60,其中B的质量分数为0.40,A的质量分数为0.1333,其余为C),而C、D形成的原子个数比1∶2的化合物(相对分子质量92)就是该燃料的氧化剂。且已知它们之间发生氧化还原反应后生成的产物对环境无污染。则该反应的化学方程式为_____________________。
(4)C元素的气态氢化物能还原CuO,生成Cu、C单质及A与D形成的化合物,该反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com