
(12分)四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备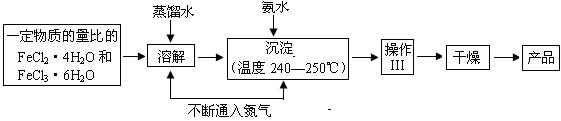
(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通 入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
(2)操作Ⅲ的名称是________▲___ 。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水(其它用品任选)
(3)请选用上述试剂完成下表
| 步骤 | 操作 | 现象、结论 |
| 1 | ▲ |  |
| 2 | 取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 | 固体溶解,溶液呈浅黄色 |
| 3 | 取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 | ▲ ,产品含有Fe3+ |
| 4 | ▲ | ▲ ,产品含有Fe2+ |
 滴定,至终点时消耗KMnO4溶液体积29.80mL。
滴定,至终点时消耗KMnO4溶液体积29.80mL。 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| 1 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备
(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
(2)操作Ⅲ的名称是________▲___ 。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水 (其它用品任选)
(3)请选用上述试剂完成下表
| 步骤 | 操作 | 现象、结论 |
| 1 | ▲ |
|
| 2 | 取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 | 固体溶解,溶液呈浅黄色 |
| 3 | 取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 | ▲ ,产品含有Fe3+ |
| 4 | ▲ | ▲ ,产品含有Fe2+ |
二、定量测定:
称取23.2g样品于烧杯中,加入加热煮沸后的稀硫酸充分溶解,并不断加热、搅拌,待固体完全溶解后,向所得溶液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6g。取滤液体积的1/10用浓度为0.200 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL。
(4)产品中Fe3+和Fe2+的物质的量之比为 ▲ 。
III.结果讨论
(5)产品中Fe3+和Fe2+的物质的量之比略大于2:1的可能原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:实验题
(12分)四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备

(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
(2)操作Ⅲ的名称是________▲___ 。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水 (其它用品任选)
(3)请选用上述试剂完成下表
|
步骤 |
操作 |
现象、结论 |
|
1 |
▲ |
|
|
2 |
取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 |
固体溶解,溶液呈浅黄色 |
|
3 |
取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 |
▲ ,产品含有Fe3+ |
|
4 |
▲ |
▲ ,产品含有Fe2+ |
二、定量测定:
称取23.2g样品于烧杯中,加入加热煮沸后的稀硫酸充分溶解,并不断加热、搅拌,待固体完全溶解后,向所得溶液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。取滤液体积的1/10用浓度为0.200 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL。
(4)产品中Fe3+和Fe2+的物质的量之比为 ▲ 。
III.结果讨论
(5)产品中Fe3+和Fe2+的物质的量之比略大于2:1的可能原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题
 用浓度为0.200mol?L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL.计算产品中Fe3+和Fe2+的物质的量之比.(写出计算过程)
用浓度为0.200mol?L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL.计算产品中Fe3+和Fe2+的物质的量之比.(写出计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com