
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
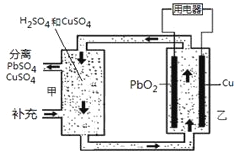
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
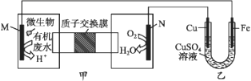
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数一定相等的是
①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体④同压强、同体积的 N2和 CO两种气体.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )
2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )

A. 保持压强不变,升高反应温度
B. 保持温度不变,增大容器体积
C. 保持温度和容器体积不变,充入1 mol SO3(g)
D. 保持温度和压强不变,充入1 mol SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。
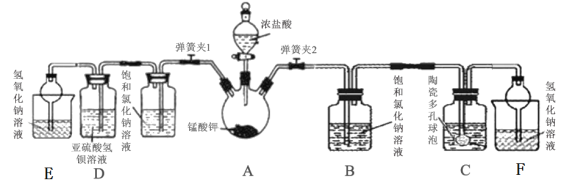
(1)检验该套装置气密性的方法是:______________________________;
(2)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:_________________________________________;
(3)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因:________;
(4)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为:________________________________;(写名称)
②陶瓷多孔球泡的作用是:_________________________________________________;
(5)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点。已知氧化性:ClO-> IO3-> I2
①所选的指示剂为:______________,到达滴定终点的标志是:______________________;
②该漂白粉中有效成分的质量分数为:__________________________。
(6)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为:______________;该现象能够证明氯气有氧化性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)![]()
![]() Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 | CH3OH的浓度 | 能量变化 |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
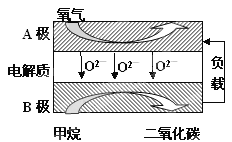
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com