
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
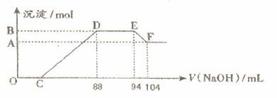
⑴B与A的差值为 mol。
⑵C点对应的溶液体积为 mL。
⑶原硝酸溶液中含硝酸的物质的量为 mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为 。
⑸写出铝与该浓度硝酸反应的离子方程式 。
【答案】⑴0.05 ⑵40 ⑶0.5 ⑷5:3 ⑸8Al+30H++3NO3-=8Al3++3NH4++9H2O
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①0→C:H++OH-=H2O;②C→88:R3++3OH-=R(OH)3↓(R代表Fe或Al);③88→94:NH4++ OH-=NH3•H2O;④94→104:Al(OH)3+ OH-=AlO2-+ 2H2O。由④知n[Al(OH)3]=0.01L×5mol·L-1=0.05 mol=n(Al),此值也是B与A的差值。由③知,n(NH4NO3)= 0.006L×5mol·L-1=0.03 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.03×8=0.24 mol,则n(R3+)=0.08 mol=n(合金),故混合物中n(Al):n(Fe)=5:3。0→88mL中,用于沉淀金属离子的OH-有0.08 mol×3=0.24 mol,故C点:(0.088L×5 mol·L-1-0.24 mol)/ 5 mol·L-1=0.04L,即40mL。
【考点】化学计算与技巧,元素及其化合物


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
(12分)钢铁表面发蓝(或发黑,在钢铁表面形成一层致密的氧化物Fe3O4)可提高其耐磨、耐蚀性能。其原理是:
①在NaOH溶液中,将铁粉溶解在NaNO2溶液中,除水之外,还可产生A和C。其中C为气体,能使湿润的红色石蕊试纸变蓝。
②A能在过量的NaNO2溶液中继续反应,生成B和C。
③A和B的溶液能继续反应,生成Fe3O4。
经研究发现:A和B的焰色反应均为黄色,其导电性实验均为K2SO4型。生成物中A与C、B与C的物质的量之比均为31。回答下列问题:
4-1 写出并配平化学反应方程式。
4-2 实践中发现适当提高温度或增大NaNO2溶液的浓度有利于氧化膜增厚,但加大NaOH溶液浓度对膜层厚度影响不大。试说明原因。
4-3 发蓝层遇光气(COCl2),若不及时清洗,则发蓝层的完整性将被破坏。写出有关的化学反应方程式。
4-4 有一种隐形材料D可由B与Zn(NO3)2 反应生成,也可用以硝酸铁、硝酸锌、氢氧化钠等为原料的水热合成法。请确定D的化学式,并判断上述制备D的反应是否属于氧化还原反应。此法所得产品D能够隐形的原因是什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com