
| A. | “四中子”不显电性 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
分析 A.中子不带电;
B.质量数=质子数+中子数,质量与质量数成正比;
C.“零号元素”指由四个中子构成的粒子,无质子,不属于元素;
D.同种元素组成的不同单质互称同素异形体.
解答 解:A.因中子不带电,则由四个中子构成的“四中子”粒子不带电,故A正确;
B.因中子的质量数为1,则“四中子”的质量数为1×4=4,氢原子质量数是1,“四中子”质量比氢原子大,故B正确;
C.因为它不是某种元素,而只有中子,故周期表中没有该“元素”的位置.故C错误;
D.由四个氧原子构成的分子,其分子式为O4,与O2都是氧元素是不同单质,互为同素异形体,故D正确.
故选C.
点评 本题考查了原子的构成微粒的性质及同位素、同素异形体等概念,题目难度不大,注重信息和所学知识的结合来解答.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
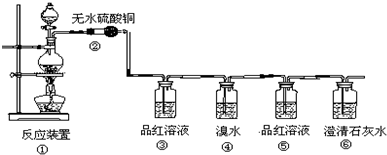
 SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ②⑤ | C. | ④⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
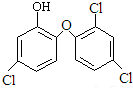
| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 三氯甲烷只有一种结构,可推知CH4是正四面体 | |
| C. | 三氯生能与NaOH溶液反应 | |
| D. | 常温下,三氯生易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
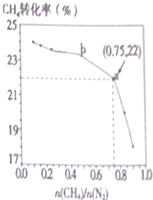 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )| A. | n(CH4)/n(N2)越小,CH4的转化率越高 | |
| B. | n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 | |
| C. | b点对应的平衡常数与a点一样 | |
| D. | a点对应的NH3的体积分数约为26% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.25 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v (C)=0.3 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
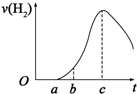 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com