
将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
①待产生的气体全部释放后,向溶液加入VmL amol·L-1 NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源:2017届广东省韶关市六校高三上10月联考化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图

离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式_________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源:贵州省铜仁市2016-2017学年高一上期中化学试卷(解析版) 题型:实验题
用Na2CO3·10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、胶头滴管,还缺少。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为g。
(3)配制溶液时有以下几个操作:①溶解、②摇匀、③洗涤并转移、④冷却、⑤称量、⑥转移溶液、⑦定容、⑧装瓶贴标签,则正确的操作顺序是 (填序号)。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空。
①碳酸钠失去了部分结晶水
②用“左码右物”的称量方法称量晶体并使用了游码
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
⑥转移液体时不小心洒落了一滴在容量瓶的外面
⑦定容时俯视刻度线,
⑧摇匀后,凹液面低于刻度线未做任何处理
其中引起所配溶液浓度偏高的有,偏低的有,无影响的有。(填序号)
查看答案和解析>>
科目:高中化学 来源:贵州省铜仁市2016-2017学年高一上期中化学试卷(解析版) 题型:选择题
2008年9月4日辽宁阜新市清河口区河西镇八矿,井下发生了瓦斯爆炸事故,事故共造成14人死亡,2人下落不明。实验证明,瓦斯中CH4和O2的体积比为1∶2时爆炸威力最大,则此时CH4和O2的质量比为
A.1∶1
B.1∶2
C.1∶4
D.2∶1
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月月考化学试卷(解析版) 题型:选择题
含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A.曲线a表示Fe2+,曲线b表示Fe3+
B.P点时总反应的离子方程式可表示为5Fe+16H++NO3-=3Fe2++2Fe3++4NO↑+8H2O
C.n2=0.25
D.n3:n1=3:2
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.根据反应 说明碳的非金属性强于硅的非金属性
说明碳的非金属性强于硅的非金属性
B.加热分解CuSO4·5H2O过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒
C.最高化合价为+7的元素一定属于主族元素
D.16g O3含有8NA个电子
O3含有8NA个电子
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上10月模块测试化学试卷(解析版) 题型:选择题
已知酸性:H2CO3>HClO>HCO3﹣,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl﹣、Ba2+、Br﹣能大量共存
B.向溴水中加入足量氯化亚铁溶液能使溶液变成无色
C.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三上统一考试化学试卷(解析版) 题型:填空题
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
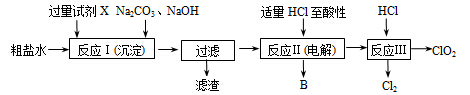
(1)粗食盐水中含有Ca2+、Mg2+、SO 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com