
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是:
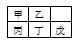
A. 原子半径: 丙<丁<戊 B. 氢氧化物碱性:丙>丁>戊
C. 金属性:甲>丙 D. 最外层电子数:甲>乙
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:河北省石家庄市2016-2017学年高一下学期学情反馈(一)(解析版) 题型:选择题
在标准状况下,在三个干燥的烧瓶内分别装有:干燥纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一3月月考化学试卷(解析版) 题型:选择题
起固氮作用的化学反应的是( )
A.工业上用氮气和氢气合成氨气 B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮 D.由氨气制碳酸氢氨和硫酸氨
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高一3月月考化学试卷(解析版) 题型:选择题
下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能够与NaOH溶液反应生成盐和水的是
A. 元素X:它的原子中M层比L层少2个电子
B. 元素Z:位于元素周期表中第三周期,ⅢA族
C. 元素Y:它的二价阳离子核外电子总数与氩原子相同
D. 元素W:它的焰色反应颜色呈紫色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高一3月月考化学试卷(解析版) 题型:选择题
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层电子都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏孔德校区高一下学期第一次(3月)月考化学试卷(解析版) 题型:填空题
以下属于放热反应的有______________________(填序号)。
①钢铁生锈 ②铝热反应 ③Na2O2与水反应 ④铜和稀硝酸反应
⑤Ba(OH)2·8H2O和NH4Cl晶体的反应 ⑥C和水蒸气反应制备水煤气 ⑦C和CO2反应
⑧酸碱中和反应 ⑨碳酸钙分解 ⑩天然气的燃烧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏孔德校区高一下学期第一次(3月)月考化学试卷(解析版) 题型:选择题
下列关于化学键的说法不正确的是 ( )
A.并不是所有物质都含有化学键
B.只有非金属原子间才能形成共价键
C.单质不可能含有离子键
D.共价化合物中不可能含有离子键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省衡阳市高一下学期(3月)五科联赛理科综合化学试卷(解析版) 题型:填空题
某研究性学习小组,利用固体Na2SO3与中等浓度的H2SO4反应,制备SO2气体并进行有关性质探究实验。该反应的化学方程式为:Na2SO3(s)+H2SO4=Na2SO4 ↑+H2O+ SO2↑,除固体Na2SO3和中等浓度的H2SO4外,可供选择的试剂还有:
①溴水②浓H2SO4③品红试液④紫色石蕊试液
⑤澄清石灰水⑥NaOH溶液⑦氢硫酸(H2S的水溶液)
回答下列问题:
(1)欲验证SO2的漂白作用,应将SO2气体通入______(填物质编号),观察到的现象是______;
(2)欲验证SO2的还原性,应将SO2气体通入______(填物质编号),观察到的现象是______;
(3)为说明SO2的氧化性,应将SO2气体通入______(填物质编号),发生的化学反应方程式为______;
(4)为防止多余的SO2气体污染环境,最好将尾气通入______(填物质编号),反应离子方程式为______。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省合肥市高三第二次教学质量检测理综化学试卷(解析版) 题型:简答题
亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+ Cl2(g) | K3 |
则ΔH3=_________(用ΔH1、ΔH2表示);K3=__________(用K1、K2 表示)
(2)300℃时,在一密闭容器中发生反应:2ClNO(g)  2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
则n=________;k=___________;达到平衡后,若减小压强,则混合气体的平均分子量将_______(填“增大”、“减小”或“不变”)。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生反应:2NO(g)+Cl2(g)  2ClNO(g) ΔH
2ClNO(g) ΔH
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则ΔH________0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________。

②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com