
X、Y、Z、W均为短周期主族元素,原子序数依次递增。X与Z位于同一主族,Z的核外电子数是X的2倍,Y、Z、W原子的最外层电子数之和等于Z的核外电子总数。下列说法正确的是
A. 原子半径由小到大的顺序:X<Y<Z<W
B. Z的最高价氧化物对应的水化物为弱酸
C. 在一定条件下,Y单质可以与氧化铁发生置换反应
D. 常温下,0.1mol•L-1 W的氢化物水溶液的pH>1
科目:高中化学 来源:2016-2017学年浙江省台州市高二上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列各组中的两种有机物,其最简式相同但不是同系物的是( )
A. 甲酸与硬脂酸 B. 甲醇与甘油 C. 苯酚与苯甲醇 D. 苯与苯乙烯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
对于某盐溶液的检验,其结论一定正确的是
A. 加入稀盐酸产生无色气体,该气体可使澄清石灰水变浑浊,则一定含有CO32-
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定含有SO42-
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定含有NH4+
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:填空题
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
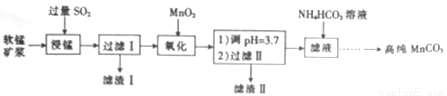
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。

(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
下列图像与对应叙述相符合的是

A. 图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B. 图乙表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:实验题
氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是_______(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
下列实验用来证明SO2的存在,其中正确的是
A. 能使品红褪色
B. 能使湿润的蓝色石蕊试纸变红
C. 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于
稀盐酸
D. 通入新制氯水中能使新制氯水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:计算题
常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是______________(用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-)___________(填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)=____________mol/L, c(OH-)- c(HA)=____________mol/L
常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH_________7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH___________7(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:实验题
在半导体工业中,有一道工序叫烧氢。烧氢的工艺流程如图所示。

工作时,是将石英管D出口处氢气点燃。半导体硅片、焊片和金属零件从石英管口送入加热区,在氢气还原气氛中加热使焊片熔化,将单晶硅与金属零件焊接在一起。焊接后再将零件拉至冷却区,冷却后取出。烧氢工艺中的氢气纯度要求极高,工业氢气虽含氢量达99.9%,但仍含有极微量的水蒸气和氧气,所以点燃氢气前应检验氢气的纯度。试回答下列问题:
(1)装置B的作用是________;B中发生反应的化学方程式是________。
(2)装置C中的物质是________;C的作用是________。
(3)点燃氢气前将E(带导管胶塞)接在D出口处,目的是________。
(4)装置A是安全瓶,可以防止氢气燃烧回火,引起爆炸,其中填充大量纯铜屑的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com