
【题目】酸雨的pH小于5.6,下列气体排放可能会形成酸雨的是
A.N2 B.CO C.SO2 D.氟氯代烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在Fe、Cu的混合物中,加入一定量的稀HNO3 并微热。充分反应后剩余金属ag。再向其中加入一定量的稀盐酸并加热,充分振荡后还剩金属bg ,则( )
A. a 可能等于b B. a 一定等于b
C. a 可能小于b D. a 一定大于b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转换的说法正确的是( )
A.天然气燃烧是化学能转化为热能的过程
B.二次电池放电的过程是电能转化为化学能的过程
C.燃煤发电是从煤中的化学能经过一系列能量转换最终转化为电能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变为热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
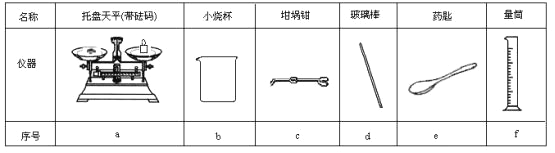
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图6中选择称量NaOH固体所需要的仪器是(填字母): 。
Ⅱ.测定中和热的实验装置如图7所示。

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 (中和热数值为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
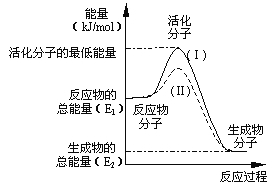
①图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式 。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x= (用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag+ + □ = □PO43-+ □Ag +□
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下
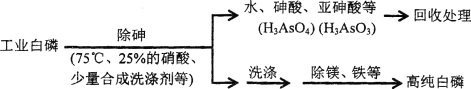
①除砷过程在75℃下进行,其合理的原因是_______(填字母)。
a.温度不宜过高,防止硝酸分解 b.适当提高温度,加快化学反应速率
c.使白磷熔化,并溶于水 d.降低白磷的毒性
②硝酸氧化除砷时被还原为NO,若氧化产物为等物质的量的亚砷酸与砷酸,则化学反应方程式为_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com