
【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的________(填序号)。
CH3OH(g)反应达到平衡状态的________(填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=____, m =_____, n =_____。
【答案】CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41.4 kJ·mol-1 0.05mol/(L·min) 225 减小 增大压强或增大氢气浓度或按原比例等倍加入反应物 bd 1596 2 1
H2(g)+CO2(g) △H=-41.4 kJ·mol-1 0.05mol/(L·min) 225 减小 增大压强或增大氢气浓度或按原比例等倍加入反应物 bd 1596 2 1
【解析】
(1)是典型的盖斯定律的应用,注意热化学方程式需要标出各物质的聚集状态;
(2)按照表格给出的数据进行速率的计算、平衡常数的计算即可,在判断反应是否达到平衡状态时,要按照“各物质的浓度不再发生改变”为核心来进行分析;
(3)只要代入表格中的数据进行计算即可。
(1)将a式和b式相加,再除以2即可得到![]() ;
;
(2)①根据方程式不难看出![]() 和
和![]() 是按照2:1消耗的,因此在10min时
是按照2:1消耗的,因此在10min时![]() 有1mol,根据
有1mol,根据![]() 即可算出
即可算出![]() 的反应速率;在20min时
的反应速率;在20min时![]() 的物质的量为0.4mol,甲醇的物质的量为1.8mol,代入平衡常数的表达式
的物质的量为0.4mol,甲醇的物质的量为1.8mol,代入平衡常数的表达式![]() 即可;
即可;
②题干告诉我们该反应是放热,因此若30min升高温度,平衡常数将减小;
③方法有很多,例如增大压强可以使平衡向气体分子数减少的方向移动,即正向移动;也可以充入少量氢气,使平衡正向移动,提高一氧化碳的转化率;
④a.平衡时各物质的反应速率之比等于其计量数之比,故当氢气的消耗速率等于甲醇的消耗速率的两倍时,反应才达到平衡状态,a项错误;
b.该反应是一个反应前后气体分子数改变的反应,因此当混合气体的物质的量不再变化时,反应即达平衡状态,b项正确;
c.反应无时不刻在按照1:2的化学计量数之比消耗![]() 和
和![]() ,所以不能作为平衡状态的判据,c项错误;
,所以不能作为平衡状态的判据,c项错误;
d.因为反应前后气体分子数不同,故当混合气体的平均相对分子质量不变时,反应即达平衡状态,d项正确;
答案选bd;
(3)代入表中的三组数据,有①![]() ;②
;②![]() ;③
;③![]() ;三个未知数三个方程,联立①、③解得
;三个未知数三个方程,联立①、③解得![]() ,联立①、②解得
,联立①、②解得![]() ,将m、n代入任意一个方程解得
,将m、n代入任意一个方程解得![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
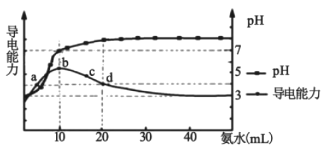
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
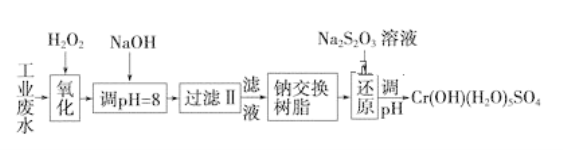
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )

A.工作时,a 极的电势低于 b 极的电势
B.工作一段时间之后,a 极区溶液的 pH 减小
C.a、b 极不能使用同种电极材料
D.b极的电极反应式为:CH3COO-+4H2O-8e-=2HCO3-+9H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2Na + 2H2O = 2NaOH + H2↑,该反应中相关物质的化学用语中正确的是
A.H2 的结构式:H-H
B.中子数为 12 的钠原子:![]()
C.H2O 的电子式:![]()
D.Na+的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是
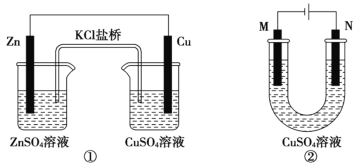
A.装置①将电能转变为化学能
B.装置①中盐桥内的 K+移向 CuSO4 溶液
C.若装置②用于铁棒镀铜,则 N 极为铁棒
D.若装置②用于电解精炼铜,溶液中的 Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(PMMA)是一种具有优良的光学性、耐腐蚀性的高分子聚合物,其合成路线之一如图所示:
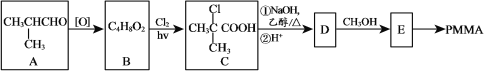
请回答下列问题:
(1)写出检验A中官能团所需试剂及现象__、__。
(2)用系统命名法给B命名__。
(3)写出C与足量的NaOH乙醇溶液,在加热条件下反应的化学方程式__。
(4)写出E生成PMMA反应的化学方程式__。
(5)下列说法正确的是__。
a.B的核磁共振氢谱有3组峰,峰面积比为6∶1∶1
b.B→C的反应类型为取代反应
c.D中存在顺反异构
d.1molPMMA发生水解反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
A元素原子的核外电子数和电子层数相等
B元素原子的核外p电子数比s电子数少1
C元素的第一至第四电离能如下:![]()
![]()
![]()
![]()
D是前四周期中金属性最强的元素
E在周期表的第七列
(1)已知BA5为离子化合物,写出其电子式:__________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有___个伸展方向,原子轨道呈 _____ 形。
(3)某同学根据上述信息,推断C元素基态原子的轨道表示式为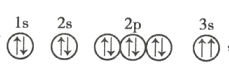 ,该同学所画的轨道表示式违背了 __________________ 。
,该同学所画的轨道表示式违背了 __________________ 。
(4)E位于第 _________ 族、 _____ 区,该元素原子的核外电子排布式为 _______。
(5)检验D元素的方法是 _____ ,请用原子结构的知识解释产生此现象的原因:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com