
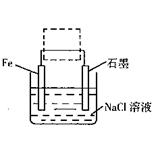
 Fe��s��+CO2��g����
Fe��s��+CO2��g���� Fe��s��+CO2��g��
Fe��s��+CO2��g��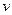 ��CO��= ��
��CO��= ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH = 3�������pH = 5������������ϣ�pH = 4 |
| B�������£�pH = 9�ļ�����Һ�У����ܴ���CH3COOH���� |
| C��������Һ�б�Ȼ��c(H+) = c(OH��) = 1��10��7 mol/L |
| D����0.1 mol/L HCl��Һ�м�������������ˮ����Һ�и������ӵ����ʵ���Ũ�Ⱦ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�� 11 | B�� 7 | C�� 5 | D�� 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ�������ͬ�����Ƕ�Ԫǿ�� |
| B������ΪһԪǿ�ᣬ����Һ������Ǽ���Һ�����3�� |
| C������Һ�������ͬ���������� |
| D������ǿ�ᣬ������Һ��Ũ�ȱ�NaOH��ҺŨ�ȴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��PH="7" | B��c��H+��=c��OH-�� |
| C��c��H+��=c��OH-��=10-7mol/L | D��c��H+����c��OH-��=10-14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.2 mol��L��1 | B��0.3 mol��L��1 | C��0.02 mol��L��1 | D��0.1 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
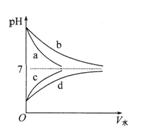
| A��a��bΪǿ����� |
| B���������c��d�ֱ���������þ�۷�Ӧ���ų�H2һ���� |
| C��c��d�����ʵ���Ũ����ͬ |
| D��pH��ȵ�a��b�ֱ��ˮϡ��m��n����pH����ȣ���m < n |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ָʾ�� | B��pH�� | C������pH��ֽ | D���㷺pH��ֽ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com