
【题目】已知①Na2O2 ②O2 ③HClO ④H2O2 ⑤Cl2 ⑥NaClO ⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_________。
(3)属于离子化合物的有______种。
(4)Na2O2、HClO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程:_________________________。
②写出Na2O2与H2O反应制备O2的化学方程式:____________________________________。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8g H2O2参加反应,则转移电子数目为_________,生成标准状况下O2体积为_______L。
【答案】②⑦ ④ 2 ![]() 2Na2O2 +2H2O=4NaOH +O2↑ 1.204x1023或0.2NA 2.24
2Na2O2 +2H2O=4NaOH +O2↑ 1.204x1023或0.2NA 2.24
【解析】
根据物质的分类的依据,熟悉同素异形体、离子化合物的概念,用电子式表示共价化合物的物质形成的过程。
(1)同种元素组成的结构不同的单质互为同素异形体。故O2与O3互为同素异形体;
(2)Na2O2既含有非极性共价键又含有离子键的离子化合物;HClO是含有极性键共价键而不含非极性共价键的化合物;H2O2既含有极性共价键又含有非极性共价键的化合物;NaClO既含有极性共价键又含有离子键的离子化合物;O2、O3、Cl2属于单质,不属于化合物,故含非极性键的共价化合物是④H2O2;
(3)由(2)可知,Na2O2、NaClO属于离子化合物,故属于离子化合物的有2种;
(4)HCl是共价化合物,用电子式表示HCl的形成过程是:![]() ;
;
(5)Na2O2与H2O反应生成氧气和氢氧化钠,其反应的化学方程式为2Na2O2 +2H2O=4NaOH +O2↑;
(6)2H2O2![]() O2↑+2H2O,每生成1mol转移2mol电子,故6.8g H2O2的物质的量:
O2↑+2H2O,每生成1mol转移2mol电子,故6.8g H2O2的物质的量:![]() =0.2mol,生成氧气的物质的量为0.1mol,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023;V(O2) = 0.1mol×22.4L·mol 1=2.24L。
=0.2mol,生成氧气的物质的量为0.1mol,转移的电子的数目为0.1mol×2×6.02×1023mol-1=1.204x1023;V(O2) = 0.1mol×22.4L·mol 1=2.24L。


科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是

(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
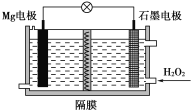
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。
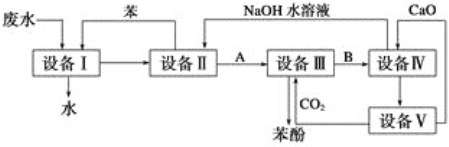
(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是打开物质世界奧秘之门的一把金钥匙 ,1869年,门捷列夫发现了元素周期律并发表了元素周期表。下图为元素周期表的一部分,回答下列问题。
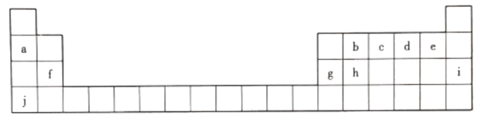
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )
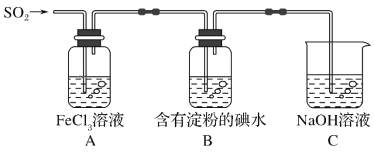
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国科学家研发了一种可充电镁一溴电池,其工作原理如图所示,电池的中间是只允许镁离子通过的离子选择性膜。电池的总反应为Mg+NaBr3===NaBr+MgBr2。下列说法错误的是( )

A. 放电过程中Mg2+通过离子选择性膜从负极区移向正极区
B. 放电时,正极反应式为Br3-+2e-=3Br-
C. 负极区电解液若改为镁盐的水溶液,则会发生副反应:Mg+2H2O===Mg(OH)2+H2↑
D. 充电过程中当0.1molMg2+通过离子选择性膜时,外电路导线中通过0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,求原溶液中Mg2+与Al3+的物质的量之比为( )

A.2:1B.6:1
C.1:2D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
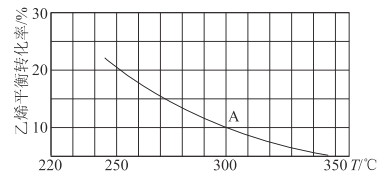
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com