
【题目】若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01%B.0.09%C.1.0%D.无法确定
科目:高中化学 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
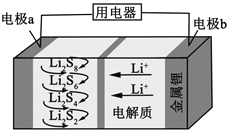
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(Mole Day)这个时间的美式写法为6:02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L的![]() 和
和![]() 混合气体中含有的碳原子数为NA
混合气体中含有的碳原子数为NA
B.1 mol![]() 与过量的水蒸气完全反应时电子转移数为2NA
与过量的水蒸气完全反应时电子转移数为2NA
C.标准状况下,5.6L ![]() 含有的分子数为0.25NA
含有的分子数为0.25NA
D.1 mol/L ![]() 溶液中含有
溶液中含有![]() 的数目为2NA
的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_________________________________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。

(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为________。
,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
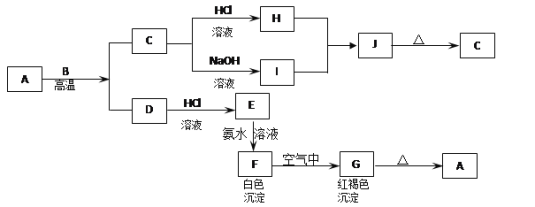
(1)写出下列物质的化学名称:A:_________I:_________J:_________G:_________
(2)写出C→I的离子方程式:_____________________________________________________。
(3)写出F→G实验现象:_________________________________________________________。
(4)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
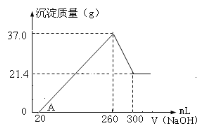
①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com