
【题目】硝酸是一种重要的化工原料,氨氧化法是工业生产中制取硝酸的主要途径,某兴趣小组在实验室模拟氨氧化法制硝酸,实验装置如图所示,回答下列问题:

(注:氯化钙可以与NH3反应生成八氨合氯化钙。)
(1)仪器a的名称为________,其中加的试剂为______________。
(2)实验时先点燃C中的酒精灯,当催化剂Cr2O3由暗绿色变为微红时通入空气,3 min后Cr2O3出现暗红色,移去酒精灯,Cr2O3能保持红热状态的原因是________,装置C中发生反应的总反应化学方程式为______________________。
(3)装置D的作用是__________________________;
装置G的作用是______________________。
(4)反应开始后,在装置E中看到的现象是______________________。
(5)实验结束后,证明有HNO3生成的操作是______________________。
(6)为测定所制硝酸的浓度,反应结束后取20 mL装置F中的液体,加水稀释至1000 mL后,取出20 mL加入锥形瓶中,滴加指示剂,然后用0.100 mol/L的NaOH溶液滴定,用去25 mL NaOH溶液,则反应制得的硝酸的浓度为________mol/L。
【答案】球形干燥管碱石灰(合理答案均可)该反应为放热反应4NH3+5O2![]() 4NO+6H2O除去氨气和水蒸气吸收尾气气体变为红棕色取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生成(合理答案均可)6.25
4NO+6H2O除去氨气和水蒸气吸收尾气气体变为红棕色取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生成(合理答案均可)6.25
【解析】
(1)仪器a为球形干燥管,作用是干燥氧气和氨气的混合气体,应选用碱性干燥剂碱石灰,故答案为:球形干燥管;碱石灰;(2)装置C中发生反应的化学反应是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O,移去酒精灯,Cr2O3固体保持红热说明反应放热,故答案为:该反应为放热反应;4NH3+5O2
4NO+6H2O,移去酒精灯,Cr2O3固体保持红热说明反应放热,故答案为:该反应为放热反应;4NH3+5O2![]() 4NO+6H2O;(3)氯化钙可以与NH3反应生成八氨合氯化钙,无水氯化钙是常用的干燥剂,故可以吸收氨气和水蒸气;装置G中盛放的是氢氧化钠溶液,可以吸收尾气,防治污染环境;故答案为:除去氨气和水蒸气;吸收尾气;(4)无色的一氧化氮与空气中的氧气反应生成红棕色的二氧化氮,故答案为:气体变为红棕色;(5)二氧化氮气体与水反应生成硝酸,硝酸遇到石蕊试液变红色,故证明有HNO3生成的操作是:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产,故答案为:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产;(6)反应制得的硝酸的浓度为
4NO+6H2O;(3)氯化钙可以与NH3反应生成八氨合氯化钙,无水氯化钙是常用的干燥剂,故可以吸收氨气和水蒸气;装置G中盛放的是氢氧化钠溶液,可以吸收尾气,防治污染环境;故答案为:除去氨气和水蒸气;吸收尾气;(4)无色的一氧化氮与空气中的氧气反应生成红棕色的二氧化氮,故答案为:气体变为红棕色;(5)二氧化氮气体与水反应生成硝酸,硝酸遇到石蕊试液变红色,故证明有HNO3生成的操作是:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产,故答案为:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产;(6)反应制得的硝酸的浓度为![]() =6.25mol/L,故答案为:6.25。
=6.25mol/L,故答案为:6.25。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
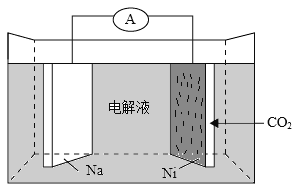
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1硫酸溶液中,乙同学将电极放入6 mol·L-1的氢氧化钠溶液中,如下图所示。
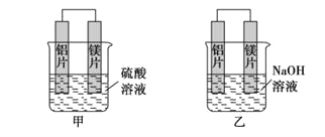
(1)写出甲池中正极的电极反应式_______________________________________。
(2)写出乙池中负极的电极反应式________________________________________。
(3)写出乙池中总反应的离子方程式_______________________________________。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(____)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________(如可靠,此空可不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以证明一水合氨是弱电解质的是
①室温下,![]() 的氨水可以使酚酞试液变红②室温下,
的氨水可以使酚酞试液变红②室温下,![]() 的氯化铵溶液的PH约为5
的氯化铵溶液的PH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱④铵盐受热易分解
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com