
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。


①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,B和X均可与A形成10电子的化合物;B与Z的最外层电子数之比为2:3,化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞变红。请回答下列问题。
(1)Z的原子结构示意图为_______,化合物BA4的电子式为__________。
(2)化合物Y2X2中含有的化学键类型有________________________。
(3)化合物A2X和A2Z中,沸点较高的是_________(填化学式),其主要原因是______。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH![]() (g)+1/2O
(g)+1/2O![]() (g)══CO(g)+2H
(g)══CO(g)+2H![]() (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol![]() ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH![]() (g)+2O
(g)+2O![]() (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol![]() ;
;
③CH![]() (g)+CO
(g)+CO![]() (g)=2CO(g)+2H
(g)=2CO(g)+2H![]() (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol![]() ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
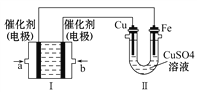
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu![]() 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
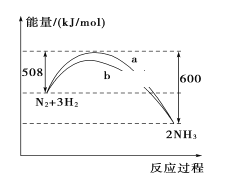
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2﹣就是一种空气负离子,其摩尔质量为( )
A.32g
B.33g
C.32gmol﹣1
D.33gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是
A. 无机苯是由极性键组成的非极性分子
B. 无机苯能发生加成反应和取代反应
C. 无机苯不能使KMnO4酸性溶液褪色
D. 无机苯的二氯取代物有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
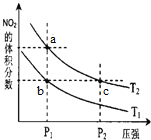
A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com