
R2O8n﹣离子在一定条件下可以把Mn2﹣氧化为MnO4,若反应后R2O8n﹣离子变为RO42离子,知反应中氧化剂与还原剂的离子数之比为5:2,则R2O8n﹣离子中R元素的化合价以及n值分别为( )
|
| A. | +7、2 | B. | +6、2 | C. | +5、1 | D. | +4、1 |
考点:
氧化还原反应的计算.
分析:
先根据化合价的变化判断氧化剂和还原剂,然后根据原子守恒配平方程式,再根据电荷守恒判断n值,确定R的化合价.
解答:
解:该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以R元素得电子化合价降低,R2O8n﹣作氧化剂,即R2O8n﹣与Mn2+的物质的量之比为5:2,根据各元素的原子守恒写出并配平该方程式为8H2O+5R2O8n﹣+2Mn2+=2MnO4﹣+10RO42﹣+16H+,根据电荷守恒得﹣5n+2×2=﹣1×2+(﹣2×10)+1×16,n=2,R2O82﹣离子中R元素的化合价为+7价.
故选:A.
点评:
本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据原子守恒和电荷守恒即可分析解答本题,难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙 . (2)分离碘和水的混合物 .
(3)分离水和汽油的混合物 . (4)分离酒精和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2的反应速率为
0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在氧化还原反应中,金属单质只体现还原性,金属阳离子只体现氧化性 |
|
| B. | 能在水溶液或熔融状态下导电的物质是电解质 |
|
| C. | 清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的散射形成的 |
|
| D. | 在一个氧化还原反应中,有一种素被氧化,必有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中加入过量的氯化钙溶液
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中加入过量的稀硫酸
④向石灰水中通入过量CO2.
|
| A. | ①② | B. | ②⑤ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是实验中常用的几种仪器

(1)写出序号所代表的仪器的名称A ;B 1 ;C ;D .
(2)上述仪器A~D使用前需要检漏的有 ;不能用于分离的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K、100 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。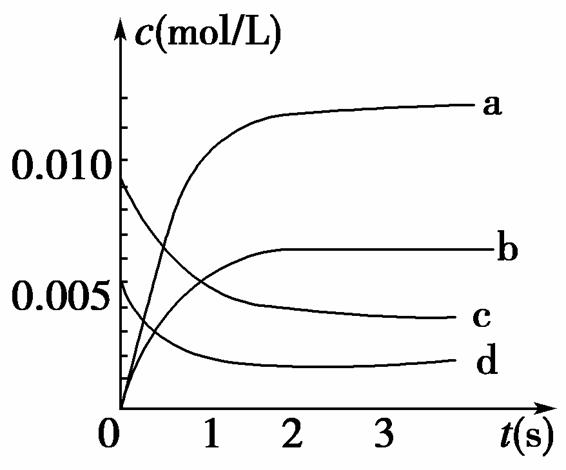
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是重要的化工原料.实验室可用浓氨水和 来制取氨气.
a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.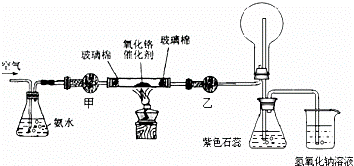
①盛放氨水的实验仪器的名称为 ;在加热条件下,硬质玻璃管中发生反应的化学方程式为 .
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是 .
③烧杯中盛有NaOH溶液的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com