
【题目】下列说法不正确的是( )
A. Mg的金属性比Al强 B. H-的离子半径大于Li+
C. HCl的热稳定性比HF强 D. HClO4的酸性比H3PO4强
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质均含有同一种元素X,它们之间有如下转化关系:
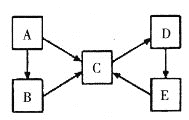
(1)若A为单质,仅B、C属于盐类,且A、B、C中元素X的化合价依次升高,C、D、E中元素X的化合价相同。则D的颜色为__________;E的名称为____________。
(2)若A为单质,B、C均属于盐类,且B、C的水溶液中含X元素的离子所带电荷数之比为3:1,D是一种白色沉淀。则元素X在周期表中的位置是____________;A→C的反应中氧化剂的化学式为___________;C→D反应的离子方程式为__________________________________。
(3)若A~E均为化合物。A是淡黄色固体,C、D、E均属于盐类,D→E→C是我国化学家发明的经典工业制备C的方法。则A的电子式为___________;D→E的化学方程式为:____________________________________。
(4)若A为单质,C、D的相对分子质量相差16,B、E发生反应只生成一种产物,且属于盐类。则B→C的化学方程式为____________________________,E→C_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试直接判断下列热化学方程式书写不正确的是( )
A. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)ΔH=-91.5 kJ/mol
HCl(g)ΔH=-91.5 kJ/mol
B. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)ΔH=+91.5 kJ/mol
HCl(g)ΔH=+91.5 kJ/mol
C. H2(g)+Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol
2HCl(g) ΔH=-183 kJ/mol
D. 2HCl(g)![]() H2(g)+Cl2(g) ΔH=+183kJ/mol
H2(g)+Cl2(g) ΔH=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下, 2SO2+O2![]() 2SO3(正反应放热)已达平衡,保持其它条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是 ( )
2SO3(正反应放热)已达平衡,保持其它条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是 ( )
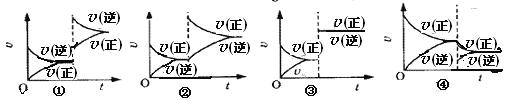
A. ①图可能是由于加压、使容器体积减小引起的
B. ②图可能是升高温度引起的
C. ③图可能是加压、缩小容器体积引起的
D. ④图是只减少了SO3的浓度引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)列式近似计算该反应在298K的平衡常数___________。
(2)如果增大氯气的压强,平衡将向______________移动。
Ⅱ、甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1)![]() HCOOH(l)+CH3OH(1) △H>0
HCOOH(l)+CH3OH(1) △H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(3)请计算15~20min范围内甲酸甲酯的减少量为____________________mol
(4)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
平均反应速率 /(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
依据以上数据,出该反应的反应速率在不同阶段的变化规律:________,其原因是:_________ 。
(5)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com