
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是

A. 反应物微粒是S、SO3-、OH-
B. 该反应说明S2-和SO32-可以在碱性溶液中可以大量共存
C. 氧化剂与还原剂的物质的量之比为1:2
D. 3molS参加反应时,转移的电子数3NA
【答案】B
【解析】
在碱性条件下,S与氢氧根离子反应生成S2-和SO32-,S元素的化合价一部分升高变为SO32-,一部分降低变为S2-,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,据此分析判断。
碱性条件下,S与氢氧根离子反应生成S2-和SO32-,S元素的化合价一部分升高变为SO32-,一部分降低变为S2-,反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价。
A.反应物微粒是S、OH-,选项A错误;
B.碱性条件下,S与氢氧根离子反应生成S2-和SO32-,二者在碱性条件下不能反应,可以大量共存,选项B正确;
C.化合价降低的硫作氧化剂,化合价升高的S作还原剂,则氧化剂与还原剂的物质的量之比为2:1,选项C错误。
D.反应中3molS发生反应,转移电子的物质的量是4mol,电子数目是4NA,选项D错误;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中或电离方程式正确的是
A. Fe2(SO4)3溶液中加入足量Ba(OH)2溶液:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
B. 向NaHSO4溶液中加入Ba(OH)2溶液至SO42-完全沉淀: 2H++SO42-+2OH-+Ba2+=2H2O+BaSO4↓
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. HSO3-在水中的电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充、放电的化学方程式为2K2S2+KI3![]() K2S4+3KI,其与充电其他设备连接的电路如图所示。当闭合开关K时,电极X附近溶液先变红。则下列说法正确的是
K2S4+3KI,其与充电其他设备连接的电路如图所示。当闭合开关K时,电极X附近溶液先变红。则下列说法正确的是
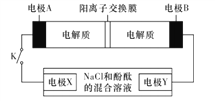
A. 放电时,电极A发生还原反应
B. 电极A的电极反应式为3I--2e-=I3-
C. 当有0.1mol K+通过阳离子交换膜时,电极X上产生气体1.12 L(标准状况下)
D. 电池充电时,电极B要与外电源的正极相连,电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4H2SO4,⑨NH3·H2O,请回答下列问题:
(1)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,
稀释后两种溶液的pH都变成9,则m_______n (填“>”、“<”或“=”)。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c (H+) =1×10-6 mol·L-1] D.向水中加入NH4Cl固体
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______。
(4)NH4Cl溶液中离子浓度大小顺序为______________。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______。
(6)己知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
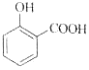 +2HCO3-→
+2HCO3-→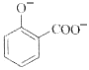 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氧化还原滴定法测定某种草酸晶体(H2C2O4·X H2O)中结晶水分子数的实验步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液;
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知:H2C2O4的相对分子质量为90。
回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在_____ (填“酸式”或“碱式”)滴定管中。
(2)H2C2O4在溶液中与KMnO4溶液反应的化学方程式是______________
(3)到达滴定终点的标志是____________。
(4)根据上述数据计算X=________________。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值_________;
②若滴定管水洗后直接加入KMnO4标准溶液,则X值_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com