
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
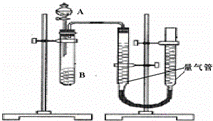
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是 .
(2)实验开始前需要检查气密性,其操作是 分液漏斗中A溶液应该 一次性 加入(填“一次性”或“逐滴滴加”).
(3)完成该实验还需要 (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是 .
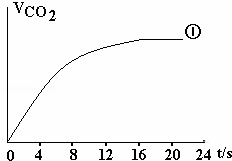
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(5)X= ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .
(6)2号反应中,H2C2O4的反应速率为 .
考点:
性质实验方案的设计.
专题:
实验设计题.
分析:
(1)根据实验①②、①③中不同的物理量判断该实验目的;
(2)使装置内外形成气压差是气密性检查的常用手段;无论避免影响测定结果,分液漏斗中的A溶液不能逐滴加入;
(3)判断反应速率需要时间,用秒表计时;
(4)②中草酸浓度小于①,③中反应物浓度相同,但③中使用了催化剂,根据浓度、催化剂对反应速率的影响画出②、③中CO2体积随时间变化的示意图;
(5)探究浓度对反应速率的影响时,溶液的总体积都为20mL,据此判断X值;由于4号实验中高锰酸钾过量,则溶液没有褪色;
(6)根据n=cV计算出反应物的物质的量,然后根据不足量计算出反应消耗的草酸的物质的量,最后根据v=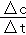 计算出H2C2O4的反应速率.
计算出H2C2O4的反应速率.
解答:
解:(1)根据表中数据可知,实验①②探究的是浓度对反应速率的影响,实验①③探究的是催化剂对反应速率的影响,所以该实验的目的是探究温度、催化剂对反应速率的影响,
故答案为:探究草酸浓度和催化剂对化学反应速率的影响;
(2)检查该装置的气密性方法为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;
为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入,
故答案为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;一次性;
(3)根据反应速率v=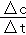 可知,需要测定时间从而判断反应速率大小,需要用秒表计时;
可知,需要测定时间从而判断反应速率大小,需要用秒表计时;
实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是使两个量气管的压强相等,避免产生压强差,影响测定结果,
故答案为:秒表;使两个量气管的压强相等,避免产生压强差,影响测定结果;
(4)实验②中其它量都与①相同,只有草酸的浓度小于①,则反应生成二氧化碳的速率小于①,反应结束时间大于①;
实验③中各物质的浓度都与实验①相同,而实验③中使用了催化剂,则反应速率大于①,反应结束时间小于①;
由于酸性高锰酸钾不足,则反应①②③生成的二氧化碳的体积都相等,
据此画出实验②、③中CO2体积随时间变化的示意图为: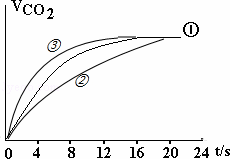 ,
,
故答案为: ;
;
(5)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1﹣4中溶液的总体积应该为20,则X=20﹣10﹣5=5;根据反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色,
故答案为:5;KMnO4溶液过量;
(6)2号实验中草酸的物质的量为:0.5mol/L×0.01L=0.005mol,高锰酸钾的物质的量为:0.2mol/L×0.005L=0.001mol,
根据反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:0.001mol× =0.0025mol,
=0.0025mol,
2号反应中,H2C2O4的反应速率为:v(H2C2O4)=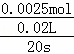 =0.00625mol/(L•s),
=0.00625mol/(L•s),
故答案为:0.00625mol/(L•s).
点评:
本题考查了探究温度、催化剂对反应速率的影响、化学反应速率的计算等知识,题目难度中等,注意掌握影响化学反应速率的因素,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.SiO2是良好的半导体材料,常用于制造计算机的芯片
C.Fe2O3俗称铁红,常用作红色的油漆和涂料
D.Na2O2用作呼吸面具中的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
以下四种物质,其中A、B各代表一种离子晶体的晶胞,C代表一种合金的晶胞,D则代表一个由A、B原子组成的团簇分子,其中化学式错误的是( )
|
| A. |
AB | B. |
XY3Z | C. |
EF | D. |
AB |
查看答案和解析>>
科目:高中化学 来源: 题型:
将右图所示实验装置,下列判断正确的是( )
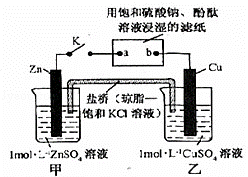
|
| A. | 电子沿Zn→a→b→Cu路径流动 |
|
| B. | 铜电极上发生氧化反应 |
|
| C. | 盐桥中的K+向甲烧杯移动 |
|
| D. | 片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某浓度的铬酸溶液(H2CrO4),向其中加入少量碱以调节pH值(忽略溶液体积变化),下表为各离子浓度(mol/L)与pH之间的关系如下表,下列说法不正确的是( )
| pH | [H2CrO4] | [HCrO4﹣] | [CrO42﹣] | [Cr2O72﹣] |
| 4 | 0 | 0.095 | 0.035 | 0.435 |
| 7 | 0 | 0.086 | 0.274 | 0.320 |
| 10 | 0 | 0.004 | 0.990 | 0.003 |
|
| A. | 铬酸的电离方程式为H2CrO4═2H++CrO42﹣ |
|
| B. | 铬酸的总浓度为1mol/L |
|
| C. | [H+]越大,HCrO4﹣浓度越大 |
|
| D. | 已知Cr2O72﹣为橙色离子,CrO42﹣为黄色离子,随着pH的升高溶液将逐渐变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列五种烃①2﹣甲基丁烷②2,2﹣二甲基丙烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是( )
A. ①>②>③>④>⑤ B. ②>③>⑤>④>① C. ③>①>②>⑤>④ D. ④>⑤>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
有8种物质:①甲烷;②苯;③聚乙烯;④异戊二烯;⑤2﹣丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③④⑤⑧ B. ④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等.PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害.下列有关叙述不正确的是( )
|
| A. | PE、PVC都属于链状高分子化合物,受热易熔化 |
|
| B. | PE、PVC的单体都是不饱和烃,能使溴水褪色 |
|
| C. | 焚烧PVC保鲜膜会放出有毒气体如HCl |
|
| D. | 废弃的PE和PVC均可回收利用以减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol乙烷和1mol氯气混合,在紫外线作用下可以发生反应,则生成的含氯有机物是( )
|
| A. | 只有CH3CH2Cl | B. | 只有CH2ClCH2Cl |
|
| C. | 只有CH2Cl2 | D. | 多种氯代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com